Synthèse 9 : CELLULES SOUCHES ET DIFFÉRENCIATION CHEZ LES ANIMAUX ET LES VÉGÉTAUX

Ce cours en ligne synthétique reprend les points de programme suivants :
- Description des cellules souches embryonnaires pluripotentes des animaux
- Description des cellules souches animales adultes
- Cellules souches méristématiques des angiospermes : description et rôles dans le fonctionnement continu des méristèmes apicaux caulinaires et racinaires (MAC et MAR)
Synthèse 9 : CELLULES SOUCHES ET DIFFÉRENCIATION CHEZ LES ANIMAUX ET LES VÉGÉTAUX
Cellules souches et différenciation cellulaire chez les animaux et les végétaux
Nous avons vu en synthèse
3 que
prolifération et différenciation font partie des processus fondamentaux de
l’embryogenèse permettant la formation des différents types cellulaires. Chez
l’homme adulte, bien que la majorité des 1014 cellules de
l’organisme ne se divisent plus, nous conservons près de 2.107
cellules capables de proliférer. Ce pool de cellules permet le remplacement des
cellules mortes ou lésées et contribuent ainsi à maintenir l’homéostasie
tissulaire (conservation à niveau constant du nombre de cellules). Chez les végétaux,
une activité proliférative est maintenue au niveau des méristèmes et assure une
croissance et une organogenèse continue (voir synthèse
5). Ces phénomènes
sont permis par l’existence, dans les tissus animaux adultes et les méristèmes
des végétaux, d’un petit réservoir de cellules appelées cellules souches,
qui vous sont présentées dans la vidéo suivante :
Trois propriétés majeures caractérisent les cellules souches :
- Elles sont indifférenciées.
- Elles ont le potentiel de générer un ou plusieurs types cellules différenciées. Selon l’étendue de ce potentiel, on parle de cellules souches totipotentes (capacité à générer toutes les cellules de l’organisme et les annexes embryonnaires), pluripotentes (capacité à générer toutes les cellules de l’organisme mais pas les annexes), multipotentes (capacité à générer plusieurs types de cellules différenciées) ou unipotentes (capacité à générer un unique type de cellules différenciées).
- Elles s’auto-renouvellent, c’est à dire qu’à l’issue de leur division, au moins une des cellules filles est identique à la cellule mère (elle reste souche ; Figure 1). L’autre cellule peut être soit une cellule souche (si la division était symétrique), soit une cellule progénitrice (si la division était asymétrique ou si l’environnement modifie sa destinée). Cette propriété est essentielle au maintien des cellules souches dans les tissus. Elle distingue ces dernières des cellules progénitrices auxquelles elles donnent naissance et qui, après un certain nombre de divisions, cesseront de proliférer pour se différencier.
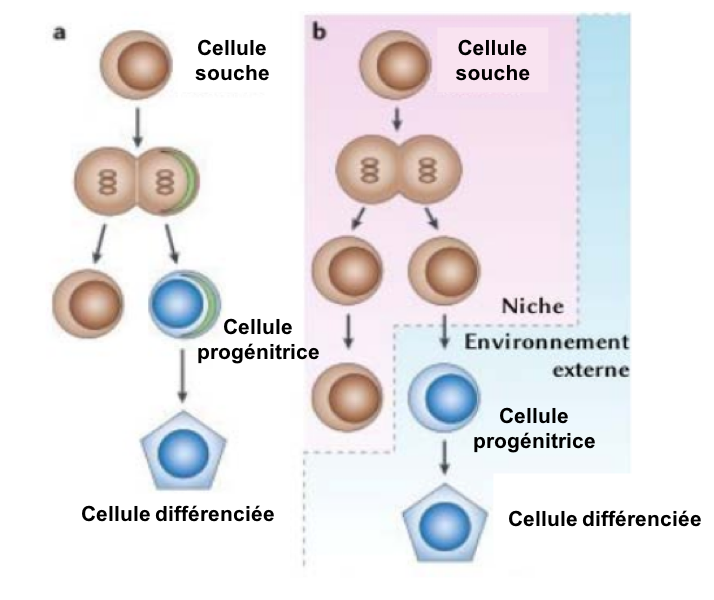
Où trouve-t-on des cellules souches dans l’organisme animal ?
Les cellules souches embryonnaires pluripotentes des animaux
La notion de cellules souches
embryonnaires provient de l’étude de tumeurs des gonades appelées tératocarcinomes (du grec « teratos »
monstre). Ces tumeurs ont été qualifiées « d’embryons désorganisés »
car elles contiennent tous les types cellulaires de l’organisme (Figure 2).
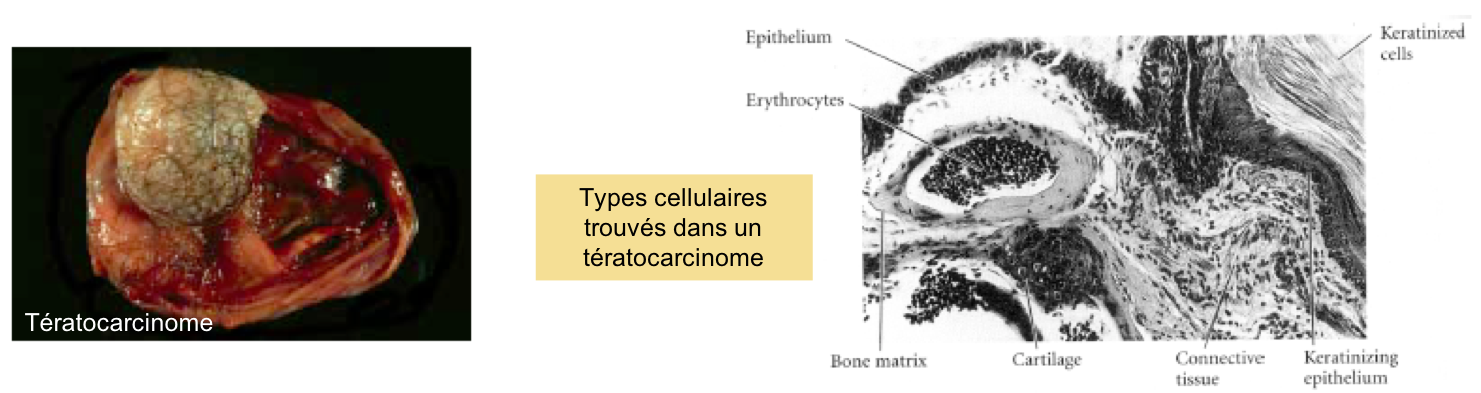
Figure 2 : Un tératocarcinome (à gauche) et son analyse histologique (à droite).
Certaines cellules au sein de la tumeur demeurent cependant indifférenciées. On les appelle cellules EC pour « Embryonic Carcinomal cells ». La transplantation clonale d’une EC (transplantation d’une unique cellule) chez un donneur engendre la formation d’une nouvelle tumeur, de nouveau composée de tous les types cellulaires possibles et de quelques cellules EC indifférenciées. Ce processus peut être répété à l’infini. Cette propriété témoigne (i) d’une capacité des EC à s’auto-renouveler (puisqu’on les retrouve à l’identique d’une transplantation à l’autre) et (ii) de leur pluripotence (puisqu’elles donnent naissance à tous les types cellulaires différenciées de l’organisme).
Des cellules aux propriétés similaires (mais non cancéreuses !) ont été découvertes dans l’embryon de mammifère (embryon de souris en 1981 puis embryon humain quelques années plus tard). On peut les isoler à un stade nommé blastocyste (Figure 3). Une fois cultivées in vitro, on les nomme cellules ES pour « Embryonic Stem cells ».
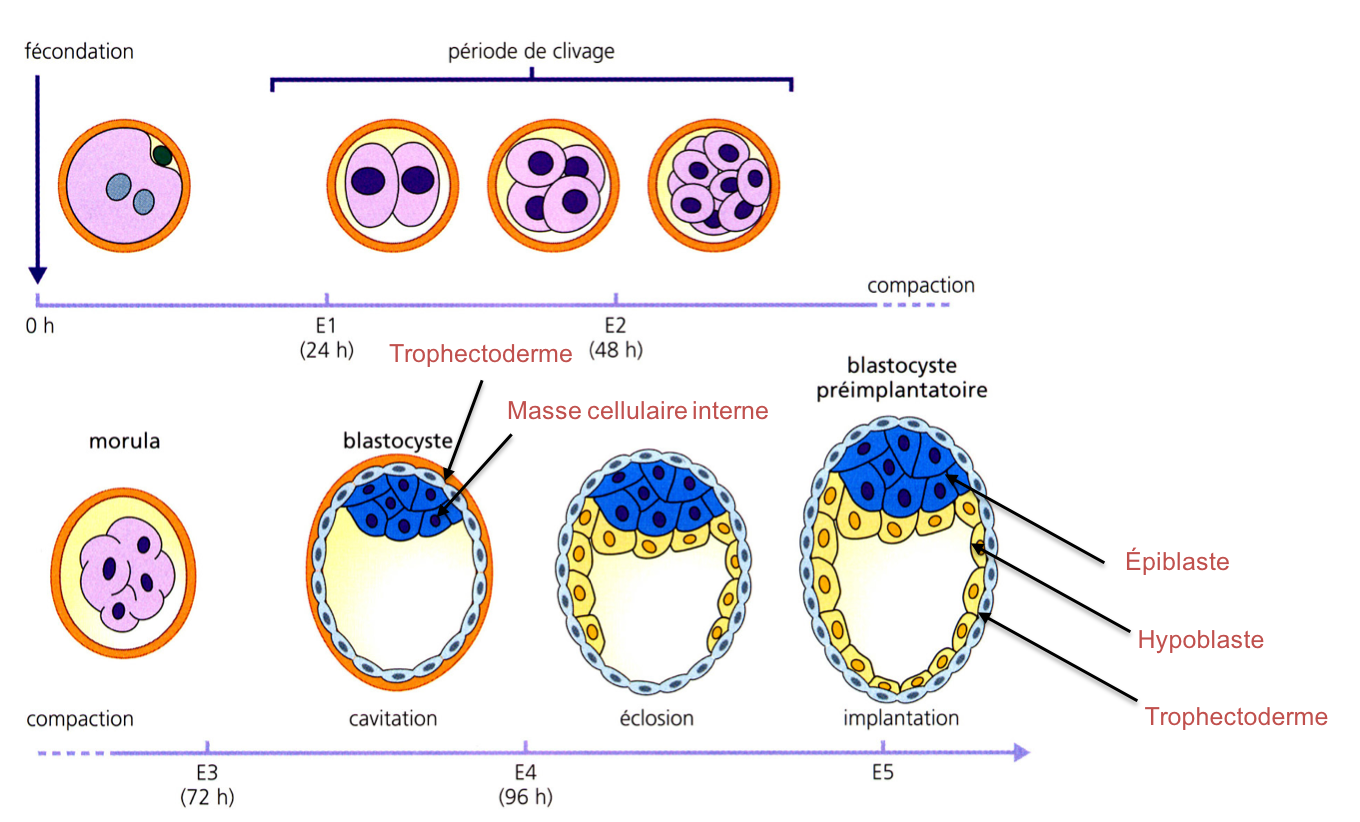
Figure 3 : Le développement précoce de l’embryon de souris. Ce schéma montre les
étapes du développement qui précèdent l’implantation de l’embryon dans l’utérus
maternel (segmentation et cavitation de l’embryon ; la gastrulation aura
lieu après l’implantation). Au stade blastocyste, une cavité s’est creusée (le
blastocoele) et deux destins sont déjà fixés : le trophectoderme
donnera le placenta et la masse cellulaire interne donnera (i) l’épiblaste
(à l’origine des tissus embryonnaires et d’une partie des annexes embryonnaires)
et (ii) l’hypoblaste (qui participera essentiellement à la formation des
annexes). Les cellules ES peuvent être isolées de la masse cellulaire
interne ou de l’épiblaste.
Les cellules ES en culture peuvent être maintenues à l’état indifférencié indéfiniment. Elles s’auto-renouvellent donc in vitro. Si on change les conditions de culture, elles se différencient et génèrent in vitro tous types de cellules différenciées. Elles sont donc pluripotentes. Leur pluripotence peut aussi être révélée in vivo après réimplantation dans un organisme. Si la réimplantation a lieu dans un embryon, elles participent à la genèse de tous les types cellulaires différenciés, comme les cellules de l’hôte. On obtient alors un individu chimérique. En revanche, si la réimplantation est effectuée dans un organisme adulte, l’absence de signaux embryonnaires appropriés les conduit à proliférer et à se différencier de façon anarchique. Il se forme alors une tumeur de type tératocarcinome (Figure 4).
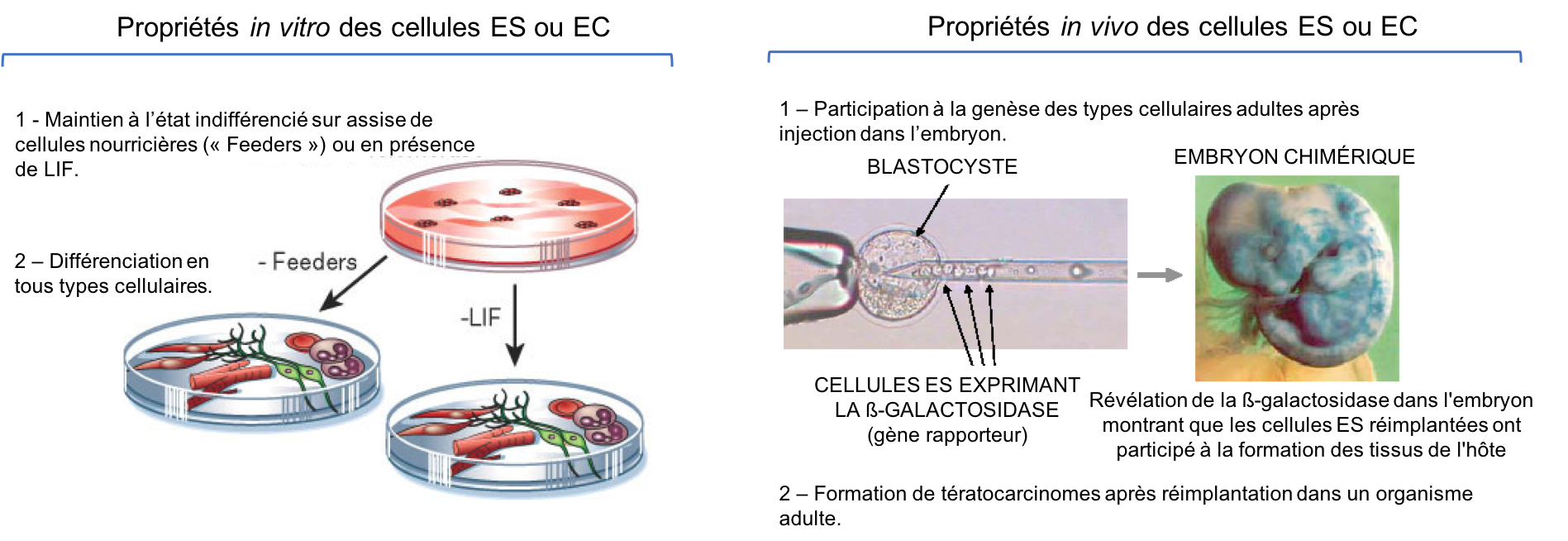
Figure 4 : Propriétés in vitro et in vivo des cellules ES et EC. In vitro, les ES ou EC de souris peuvent être maintenues à l’état indifférencié lorsqu’elles sont cultivées en présence de LIF (« Leukemia Inhibitory Factor » ; un facteur paracrine) ou sur une assise de cellules nourricières. En leur absence, elles se différencient spontanément dans les boîtes de pétri. In vivo, après injection dans un embryon receveur au stade blastocyste, on peut tracer leur lignage grâce à l’expression d’un gène rapporteur (ici le gène codant la ß-galactosidase). On s’aperçoit qu’elles contribuent à la formation de tous les tissus. L’embryon résultant est constitué de cellules issues de l’embryon receveur et de cellules issues des ES injectées. On le qualifie donc de chimérique. Enfin, on note la dangerosité de ces cellules qui, en l’absence de signaux embryonnaires (réimplantation chez l’adulte) vont exprimer toutes leurs potentialités sans contrôle et former une tumeur.
Pour réfléchir un peu… Peut-on qualifier les cellules de la masse cellulaire interne de cellules souches pluripotentes ? Oui, si on juge par leurs propriétés une fois cultivées in vitro. Non, si on considère qu’in vivo, elles ne s’auto-renouvellent pas et génèrent rapidement les trois feuillets embryonnaires endodermique, ectodermique et mésodermique (elles ne se maintiennent donc pas dans l’embryon !). Une question similaire se pose pour la cellule œuf, souvent qualifiée de cellule « souche » totipotente. Si sa totipotence ne fait pas débat (elle est bien capable de générer tous les types cellulaires de l’organisme adulte et les annexes embryonnaires le cas échéant - chez les mammifères notamment), elle ne s’auto-renouvelle pas au-delà de quelques divisions. Chez la souris, jusqu’au stade 8 cellules, les blastomères sont encore tous équivalents en termes de potentiel et peuvent après séparation générer un embryon complet et ses annexes. Mais au-delà du stade 8 cellules, cette totipotence est perdue car les premières destinées ont commencé à être fixées…
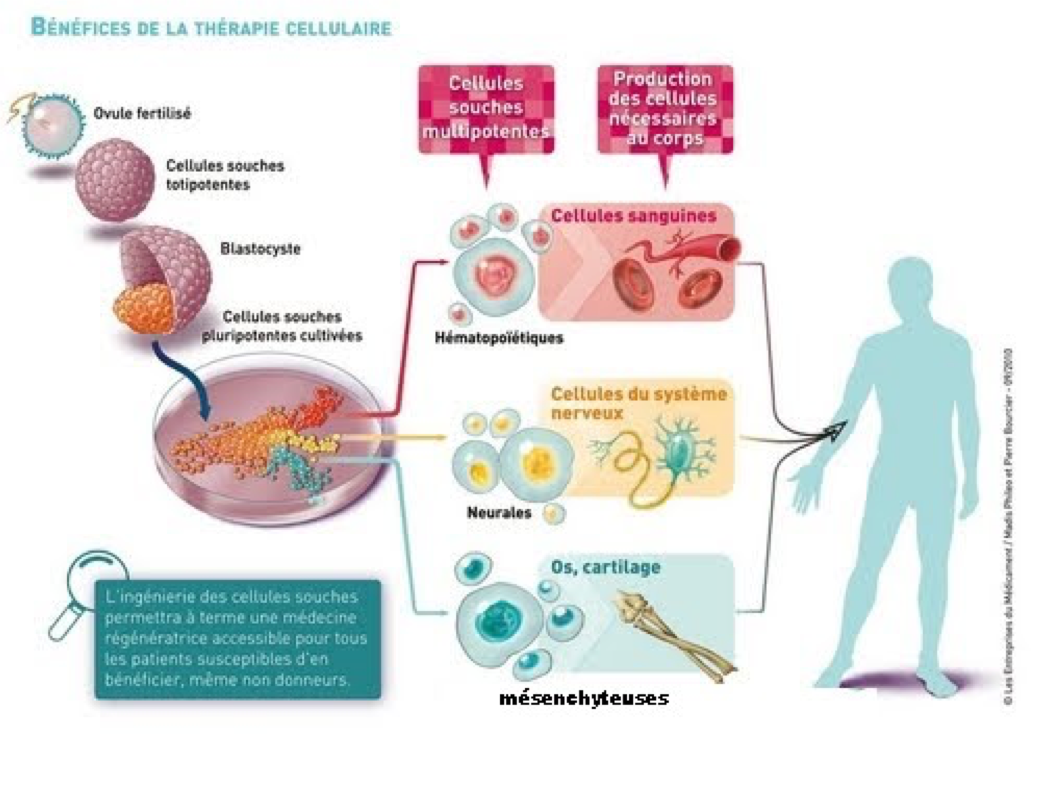
Les espoirs suscités par les ES pour la médecine régénérative
La découverte des cellules souches embryonnaires pluripotentes ES a fait naître de nombreux espoirs de traitement de diverses pathologies. Sur la base de leurs propriétés, on pouvait imaginer obtenir in vitro des cellules différenciées d’intérêt puis les greffer à des patients pour compenser une perte ou une dysfonction cellulaire (thérapie cellulaire ; Figure 5). Si l’on sait désormais « diriger » très efficacement leur destinée in vitro pour obtenir des types cellulaires différenciés de diverses natures, des obstacles persistent pour leur utilisation à des fins thérapeutiques. Tout d’abord, les dérivés différenciés doivent pouvoir être purifiés de manière à s’assurer qu’aucune cellule ES indifférenciée ne persiste dans le greffon (car sinon le risque est élevé que se développe une tumeur). Ensuite, la greffe de dérivés différenciés (sous réserve qu’elle prenne) nécessitera un traitement anti-suppresseur à vie pour éviter un rejet (traitement systématique dans le cas des allogreffes). Enfin, un grave problème éthique se pose puisque ces cellules proviennent d’embryons humains dont l’utilisation est très encadrée (en France tout du moins). La loi du 6 août 2004 sur la bioéthique (révisée en 2011 puis 2013) permet la recherche sur les embryons humains à titre dérogatoire (si et seulement si la finalité médicale est démontrée et que l’étude ne peut être menée par aucun autre moyen). Ces derniers ne peuvent provenir que d’embryons surnuméraires issus de fécondation in vitro générés dans le cadre de la procréation médicalement assistée et leur utilisation doit obtenir l’accord du couple parental concerné. Enfin, la loi proscrit totalement la conception in vitro d’embryons humain hors projet parental.
Notion de cellules souches embryonnaires induites chez les animaux
Le problème éthique mentionné ci-dessus a été levé ces dernières années grâce aux travaux de Shinya Yamanaka (prix Nobel 2012 avec John Gurdon ; voir encadré ci-après) qui a montré qu’on pouvait « reprogrammer » une cellule différenciée vers un état embryonnaire pluripotent in vitro. Le principe de cette reprogrammation repose sur l’expression forcée dans des cellules différenciées de 4 « gènes de pluripotence » collectivement appelés OKMS (Oct4, Klf4, Myc et Sox2). Ces 4 gènes ne s’expriment normalement que dans les cellules embryonnaires pluripotentes et codent pour des facteurs de transcription qui contrôlent les propriétés de ces dernières (Figure 6). Comme l’explique la vidéo suivante, leur expression dans des cellules somatiques différenciées va entraîner la dédifférenciation de ces dernières et un retour vers un état proche de celui des ES. On appelle ces cellules reprogrammées des cellules pluripotentes induites ou iPS pour « induced Pluripotent Cells » :
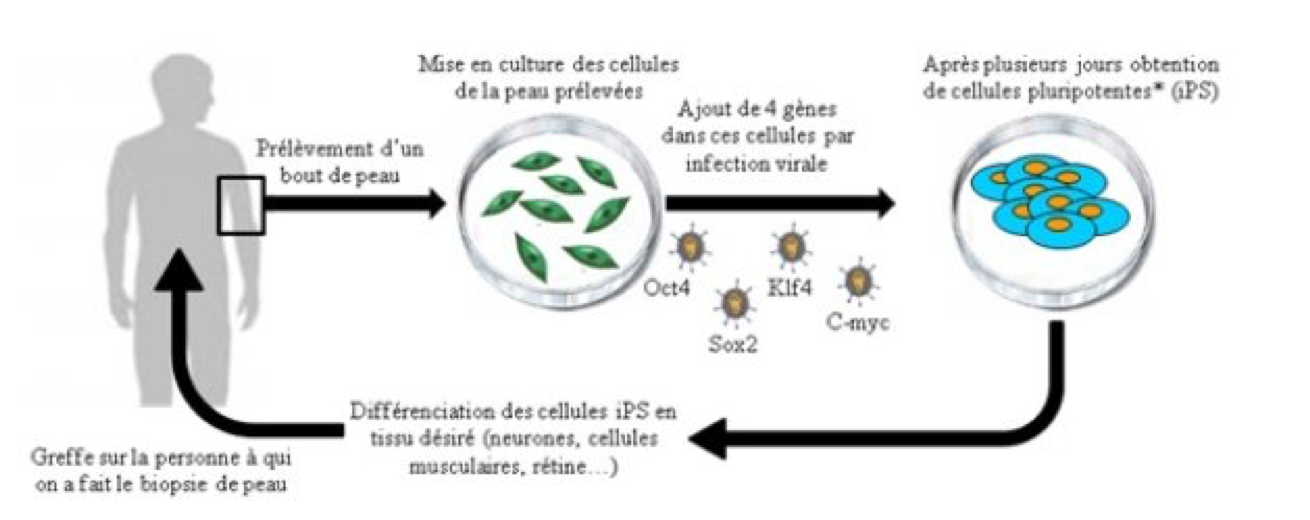 Figure 6 : Principe d’obtention des cellules iPS (ici à partir de cellules de
peau). Contrairement aux cellules ES, nul besoin ici d’un embryon. Par
ailleurs, le problème du potentiel rejet de greffe ne se pose plus car les
cellules différenciées dérivées des iPS ont le même génome que celui du patient
(on peut donc envisager une autogreffe).
Figure 6 : Principe d’obtention des cellules iPS (ici à partir de cellules de
peau). Contrairement aux cellules ES, nul besoin ici d’un embryon. Par
ailleurs, le problème du potentiel rejet de greffe ne se pose plus car les
cellules différenciées dérivées des iPS ont le même génome que celui du patient
(on peut donc envisager une autogreffe).
La recherche avance à grand pas sur ces cellules iPS et il est probable qu’elles révolutionneront la médecine régénérative dans les années à venir. Pour vous faire une idée plus concrète de la façon dont on les cultive et dont on induit leur différenciation en laboratoire, regardez la vidéo ci-dessous qui décrit le processus d’obtention de cardiomyocytes (cellules cardiaques). Nous retravaillerons sur les étapes de la différenciation d’une cellule souche en TD.
Un peu d’histoire ! Les travaux fondateurs sur la reprogrammation cellulaire ont été menés dans les années 1960 par John Gurdon (corécipiendiaire du prix Nobel en 2012) qui cherchait à l’époque à répondre à la question suivante : « le noyau d’une cellule différenciée contient-il la même information génétique que le noyau de la cellule œuf ? ». La question peut paraître triviale (vous savez que oui et que ce qui les distingue, c’est le répertoire de gènes exprimés) mais à l’époque, elle n’était pas résolue. Sa stratégie expérimentale a consisté à transférer des noyaux de cellules différenciées prélevées sur un têtard albinos dans des ovocytes préalablement énucléés (Figure 7). Après stimulation de ces ovocytes, il constata qu’ils se développaient et généraient des embryons puis des individus normaux et tous identiques au têtard donneur albinos. Il venait de mettre au point la technique de clonage par transfert nucléaire et au passage mettait en évidence sans le savoir le phénomène de reprogrammation du noyau différencié en un noyau totipotent.
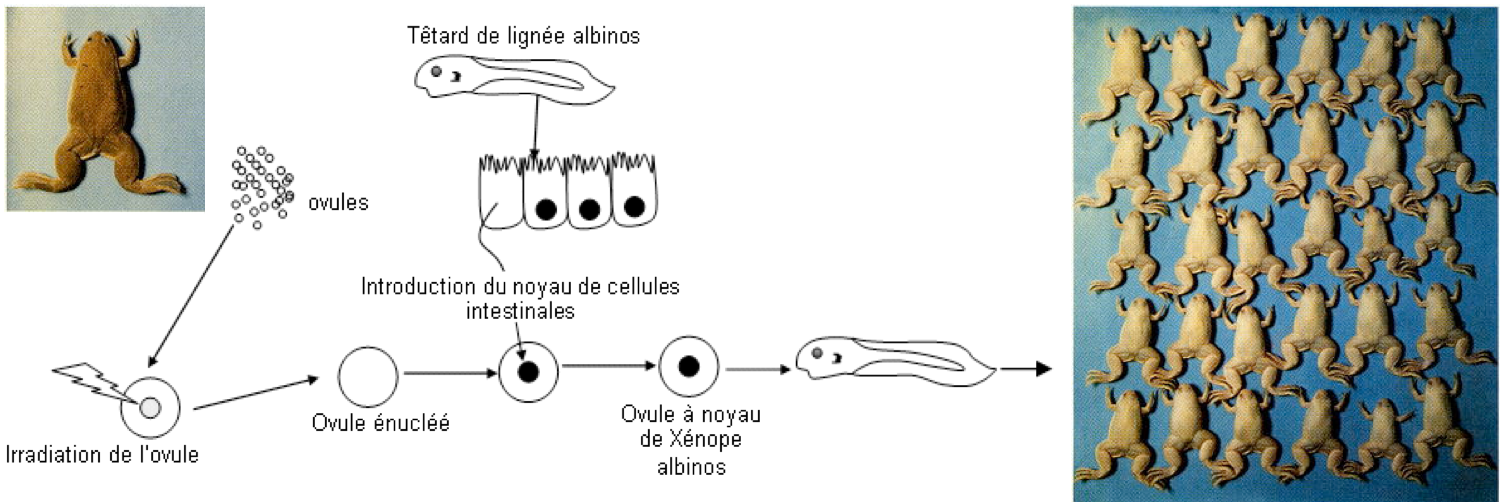
Figure 7 : L’expérience de clonage par transfert de noyaux de John Gurdon.
Les cellules souches adultes chez les animaux
Nous avons mentionné dans l’introduction
que des cellules souches adultes permettent le renouvellement tissulaire chez
l’adulte. Ces cellules sont rares (on estime
leur proportion à 1 pour 106 cellules) et elles situent dans des
microenvironnements particuliers ou « niches »
contrôlant leur auto-renouvellement et leur différenciation (via des signaux paracrines et des
interactions cellules-matrice). Leurs divisions sont peu fréquentes et leur potentiel est plus limité que celui des cellules
souches embryonnaires pluripotentes. Elles sont généralement
multipotentes (comme les cellules souches hématopoïétiques présentes dans la
moelle osseuse ; Figure 8) ou unipotentes (comme les cellules souches
musculaires nommées cellules satellites ; Figure 9). On notera que tous
les tissus adultes ne présentent pas le même taux de renouvellement. Le cœur et
le cerveau ont un renouvellement cellulaire nul ou quasi nul (les cellules
mortes ne sont pas remplacées) alors que des tissus comme l’intestin,
l’épiderme ou le tissu sanguin se renouvellent constamment.
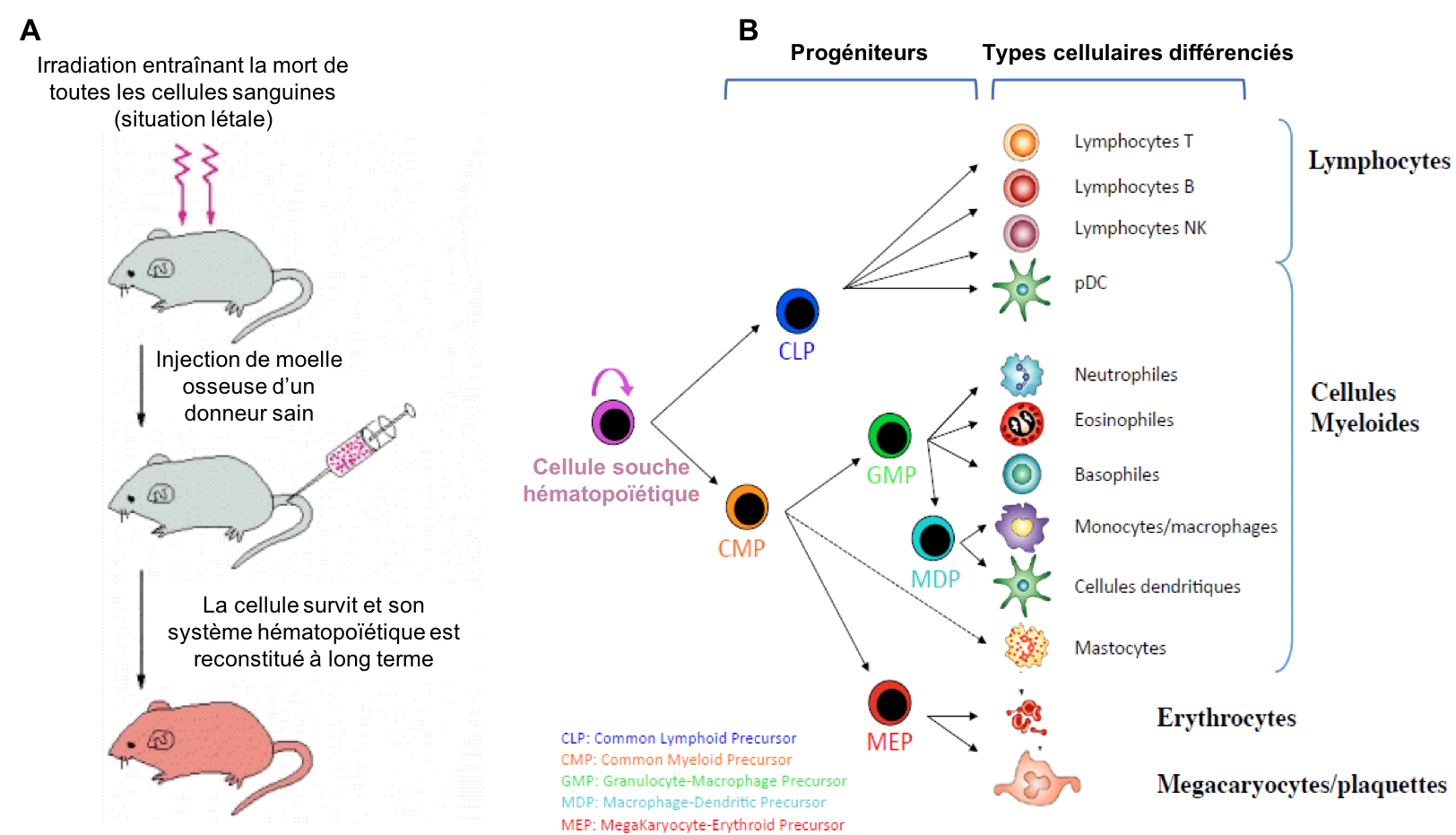
Figure 8 : Le lignage hématopoïétique. (A) Une injection de moelle osseuse restaure à long terme le système hématopoïétique d’une souris irradiée, démontrant la présence de cellules capables d’auto-renouvellement au sein de la moelle. (B) Représentation schématique du lignage hématopoïétique. Les cellules souches hématopoïétiques donnent naissance à deux types de progéniteurs : les CLP qui après division et différenciation génèrent les cellules lymphoïdes et les CMP à l’origine des cellules myéloïdes.
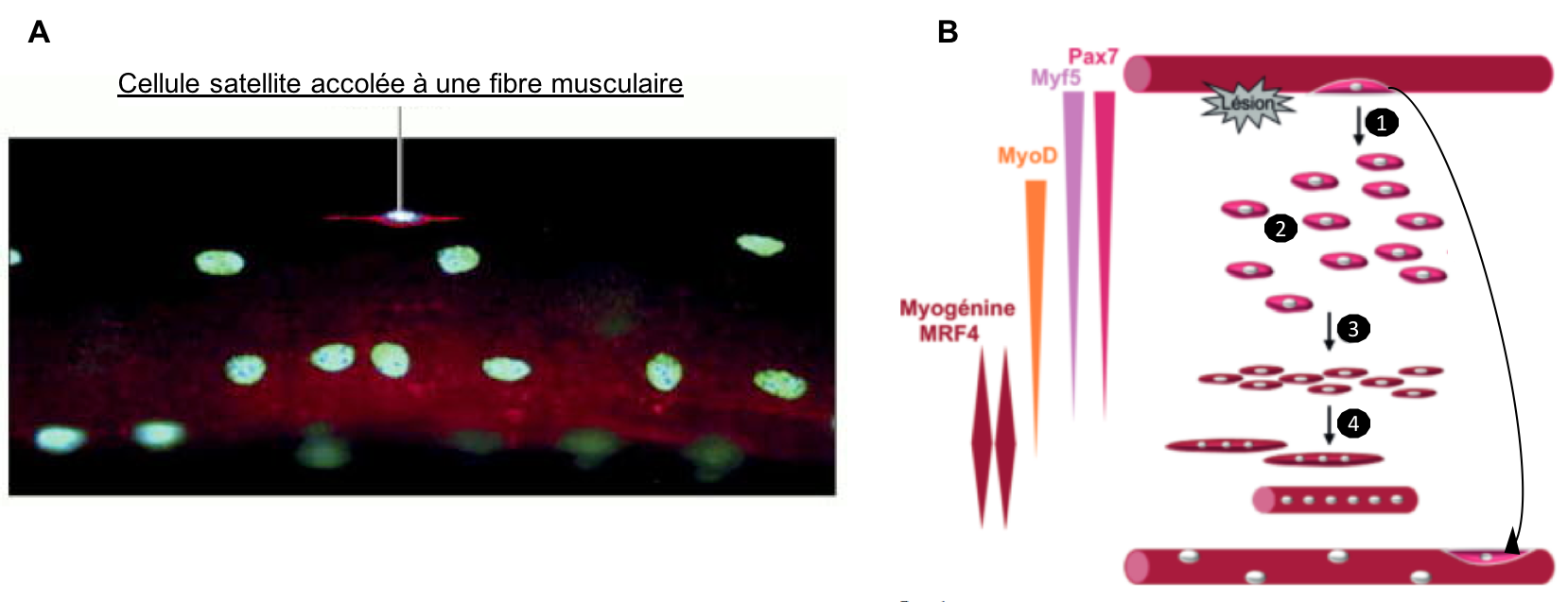 Figure 9 : (A) Les cellules satellites musculaires sont des cellules souches
situées entre la lame basale et les cellules musculaires striées dans le tissu
musculaire (fibre musculaire plurinucléée marquée en rouge; noyaux marqués en vert). En situation physiologique, elles sont quiescentes (elles ne
prolifèrent pas). (B) Après une
lésion, les cellules satellites sortent de quiescence et s’activent (1). Leur
division génère une nouvelle cellule souche (qui va ré-entrer en quiescence) et
un progéniteur myogénique (ou myoblaste) qui prolifère activement (2). Les
myoblastes sortent ensuite du cycle cellulaire et s’engagent dans le programme
de différenciation myogénique terminal (3). Ils fusionnent pour former les nouvelles fibres
musculaires (4). Les facteurs de transcription exprimés à chaque étape sont
indiqués à gauche. La formation de nouvelles fibres musculaires chez l’adulte suit
le même programme génétique que celui de la myogenèse embryonnaire (voir synthèse 3). D’après B. Chazaud Cah. Myol. 2018 ; 17 : 11-14.
Figure 9 : (A) Les cellules satellites musculaires sont des cellules souches
situées entre la lame basale et les cellules musculaires striées dans le tissu
musculaire (fibre musculaire plurinucléée marquée en rouge; noyaux marqués en vert). En situation physiologique, elles sont quiescentes (elles ne
prolifèrent pas). (B) Après une
lésion, les cellules satellites sortent de quiescence et s’activent (1). Leur
division génère une nouvelle cellule souche (qui va ré-entrer en quiescence) et
un progéniteur myogénique (ou myoblaste) qui prolifère activement (2). Les
myoblastes sortent ensuite du cycle cellulaire et s’engagent dans le programme
de différenciation myogénique terminal (3). Ils fusionnent pour former les nouvelles fibres
musculaires (4). Les facteurs de transcription exprimés à chaque étape sont
indiqués à gauche. La formation de nouvelles fibres musculaires chez l’adulte suit
le même programme génétique que celui de la myogenèse embryonnaire (voir synthèse 3). D’après B. Chazaud Cah. Myol. 2018 ; 17 : 11-14.Les cellules souches méristématiques des angiospermes
Rappels
Lors du développement post-embryonnaire des angiospermes, la plantule se développe par organogenèse et histogenèse continues, produisant sans cesse de nouveaux organes (racines, tiges, feuilles, fleurs, fruits et graines). Comme nous l’avons vu en synthèse 5, cette particularité est permise par deux méristèmes situés aux extrémités, les méristèmes apicaux racinaire (MAR) et caulinaire (MAC). Initialement formés au cours de l’embryogenèse, ces méristèmes produisent toutes les structures de la plante adulte et permettent la croissance en longueur de la plante. Le MAR produit uniquement les tissus racinaires en continuité avec la partie aérienne de la plante (la production de racines secondaires a lieu par dédifférenciation de certaines cellules du péricycle) : il est donc uniquement histogène. Le méristème caulinaire assure quant à lui la production d’organes et de tissus aériens. En phase végétative, il produit les feuilles, les tissus de la tige et les bourgeons axillaires : il est histogène et organogène. Lors du passage au stade reproductif (floraison), le MAC se transforme soit directement en méristème floral (production d’une fleur) soit en méristème d’inflorescence à l’origine de plusieurs méristèmes floraux (production de plusieurs fleurs groupées en inflorescence). Nous nous limiterons ici à son fonctionnement en phase végétative.
Auto-renouvellement des cellules souches et fonctionnement continu du MAC
Commencez par revoir l’organisation du MAC en zones et couches (synthèse 5 et Figure 10). Les cellules souches à l’origine du fonctionnement continu du MAC sont présentes dans la zone centrale.
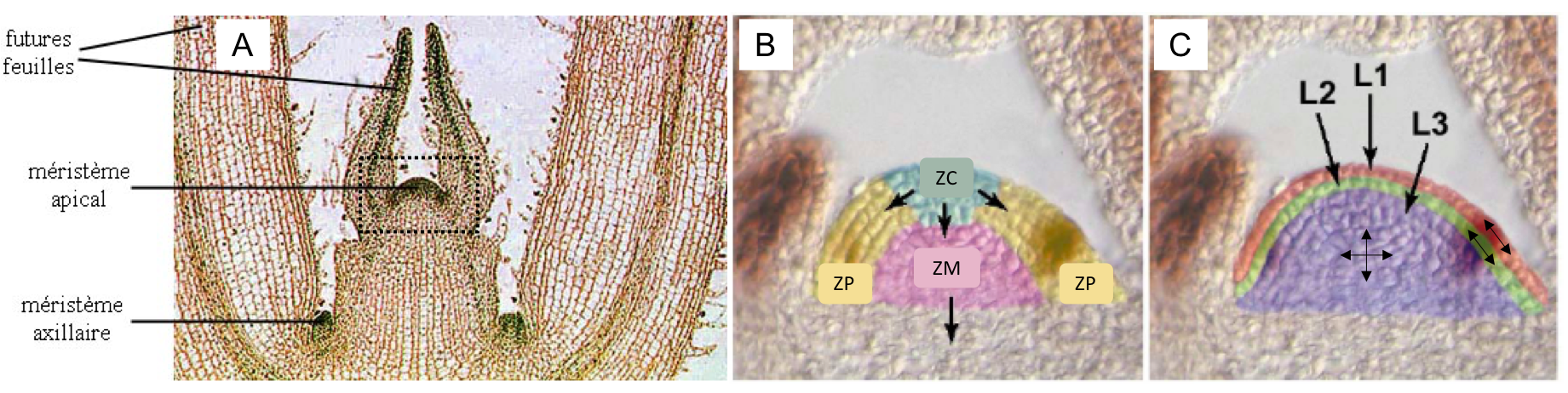
Figure 10 : (A) Coupe longitudinale d’angiosperme. Le MAC forme un dôme de 50 à 3000 µM de diamètre à sa base. (B) Organisation en zones du MAC. La zone centrale (ZC) contient les cellules souches à l’origine de tous les organes et tissus aériens. La zone périphérique (ZP) forme un anneau autour de la ZC à la surface du méristème. Elle contient les cellules progénitrices qui formeront les organes latéraux et les tissus corticaux. La zone médullaire (ZM) au centre est constituée de cellules progénitrices produisant les tissus internes axiaux de la tige, notamment la moelle et les tissus conducteurs. (C) Organisation en couches du MAC. Ces couches sont définies par les plans de divisions des cellules qui les composent : divisions principalement anticlines en L1 (genèse des cellules épidermiques) et L2 (genèse des cellules parenchymateuses) ; divisions anticlines ou périclines en L3 (genèse des tissus vasculaires).
Quels mécanismes moléculaires permettent au MAC de se maintenir au cours du temps (parfois plusieurs milliers d’années !) ? En d’autres termes, comment l’auto-renouvellement de ses cellules souches est-il assuré ? L’analyse de mutants a permis d’identifier 4 gènes fondamentaux impliqués (Figure 11) :
- Le gène WUSCHEL (WUS) est exprimé dans quelques cellules à la base de la zone centrale. Il code un facteur de transcription pouvant être transporté vers d’autres cellules via les plasmodesmes. Chez le mutant wuschel (wus ; perte de fonction), le développement du MAC s’arrête précocement après avoir formé quelques feuilles car les cellules souches sont utilisées pour la production d’organes sans être renouvelées. Le gène wus est donc nécessaire au maintien des cellules souches dans la zone centrale. Pour cette raison, on qualifie la région exprimant wus de « centre organisateur » (attention, ce n’est pas l’équivalent des centres organisateurs rencontrés au cours du développement animal comme le centre de Nieuwkoop !).
- Le gène CLAVATA 3 (CLV3) est exprimé dans la partie
de la zone centrale au-dessus du centre organisateur. Il code une protéine diffusible. Les gènes CLAVATA 1 et 2 (CLV1, CLV 2) sont
exprimés dans une zone entourant le centre organisateur et codent des récepteurs membranaires. À l’inverse du mutant wus, les trois mutants perte de fonction
clavata présentent un méristème
caulinaire très élargi, dont la taille peut atteindre mille fois celle d’un
méristème normal. Ces méristèmes produisent un nombre de feuilles et de fleurs
plus élevé que dans le cas normal. Des mesures d’activité mitotique dans les
méristèmes mutants clv3 ont montré
une accumulation de cellules dans la zone centrale ; le gène CLV3 est donc nécessaire pour limiter le
nombre de cellules souches dans la zone centrale.
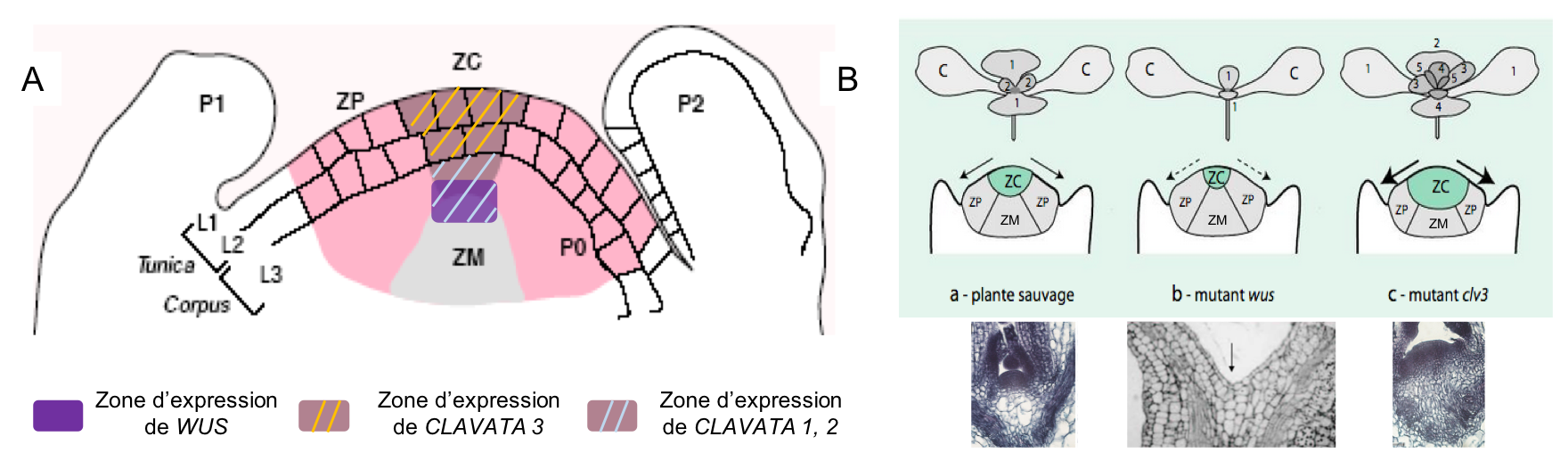
Figure 11 : (A) Représentation schématique de l’expression des gènes WUSCHEL (WUS) et CLAVATA 1-3 (CLV) dans la zone centrale du MAC. (B) Taille de la zone centrale et aspect du méristème chez une plantule sauvage (a), un mutant wus (b) et un mutant clv3 (c). (a) La ZC alimente en cellules la ZP qui produit les feuilles latérales (deux paires 1 et 2 montrées sur le schéma). (b) Dans la plantule mutante wus, la ZC est réduite. Elle fournit donc moins de cellules à la ZP et la production de feuilles est moindre par rapport à la plantule sauvage. À terme, la ZC s’épuise (la flèche sur la photo pointe l’absence de méristème après épuisement de la ZC). (c) La ZC de la plantule mutante clv3 est élargie et fournit plus de cellules à la ZP. Le méristème produit donc plus de feuilles que la plantule sauvage. C cotylédons ; ZC : zone centrale ; ZP : zone périphérique ; ZM : zone médullaire. Schéma en (B) adapté de « Biologie végétale : Croissance et développement » Ed.3 aux éditions DUNOD : http://univ.scholarvox.com.proxy.scd.u-psud.fr/reader/docid/88841927/page/92.
Nous reverrons en TD le lien entre ces 4 gènes et les mécanismes moléculaires à l’origine du maintien des cellules souches du MAR autour d’un exercice.
Auto-renouvellement des cellules souches et fonctionnement continu du MAR
Le méristème apical racinaire, localisé sous la coiffe qui le protège, génère toutes les cellules qui composeront la racine mais ne produit pas de nouvelles racines. Les cellules qui en dérivent s’allongent dans la zone d’élongation puis se différencient (revoir la Figure 8 du cours synthèse 5).
Le méristème racinaire est constitué de :
- Un groupe de cellules de taille variable (4 cellules chez A. thaliana, 1000 chez le maïs) qui ne se divisent pas ou peu après l’embryogenèse et qui constituent le centre quiescent du méristème.
- Quatre types de cellules souches adjacentes au centre quiescent, encore appelées cellules initiales. Lorsque ces cellules souches se divisent, une des cellules-filles renouvelle le stock de cellules souches et l’autre contribue à la formation des tissus racinaires (Figures 12, 13) : formation des cellules du cylindre central par les initiales de la stèle, formation du cortex et de l’endoderme par les initiales cortico-endodermiques, formation du rhizoderme et de la partie externe de la coiffe par les initiales protodermiques et formation du reste de la coiffe par les initiales de la columelle.
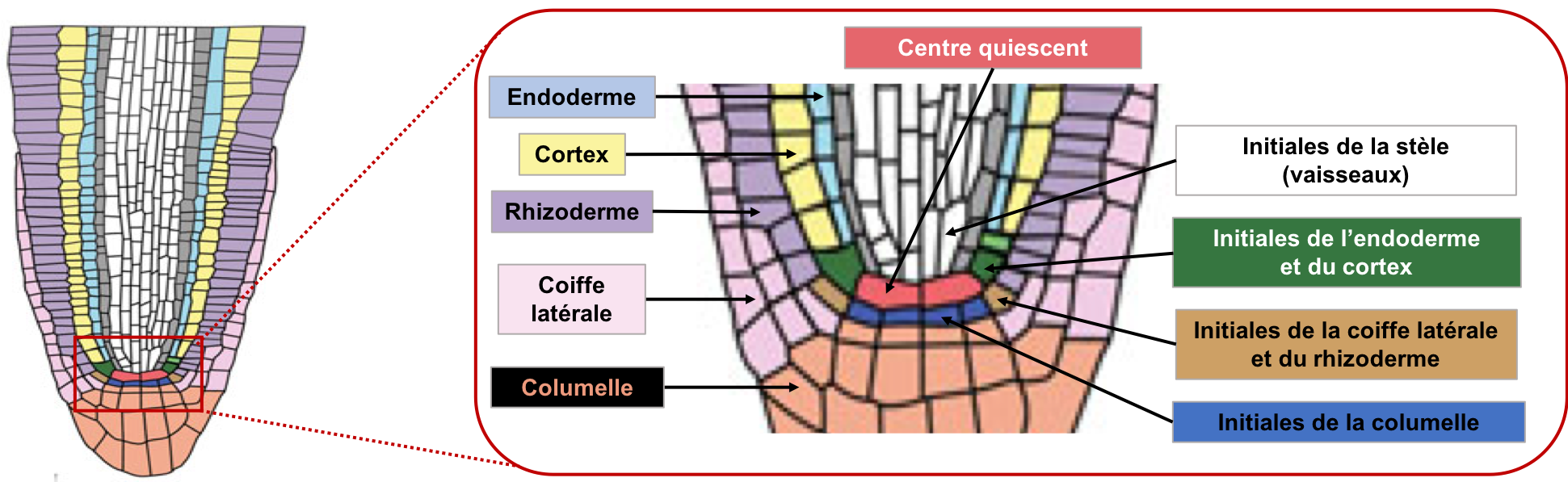
Figure 12 : Les différents types de cellules souches du MAR. À droite du schéma sont indiqués les différents types de cellules souches du MAR et à gauche les tissus racinaires auxquels elles donnent naissance.
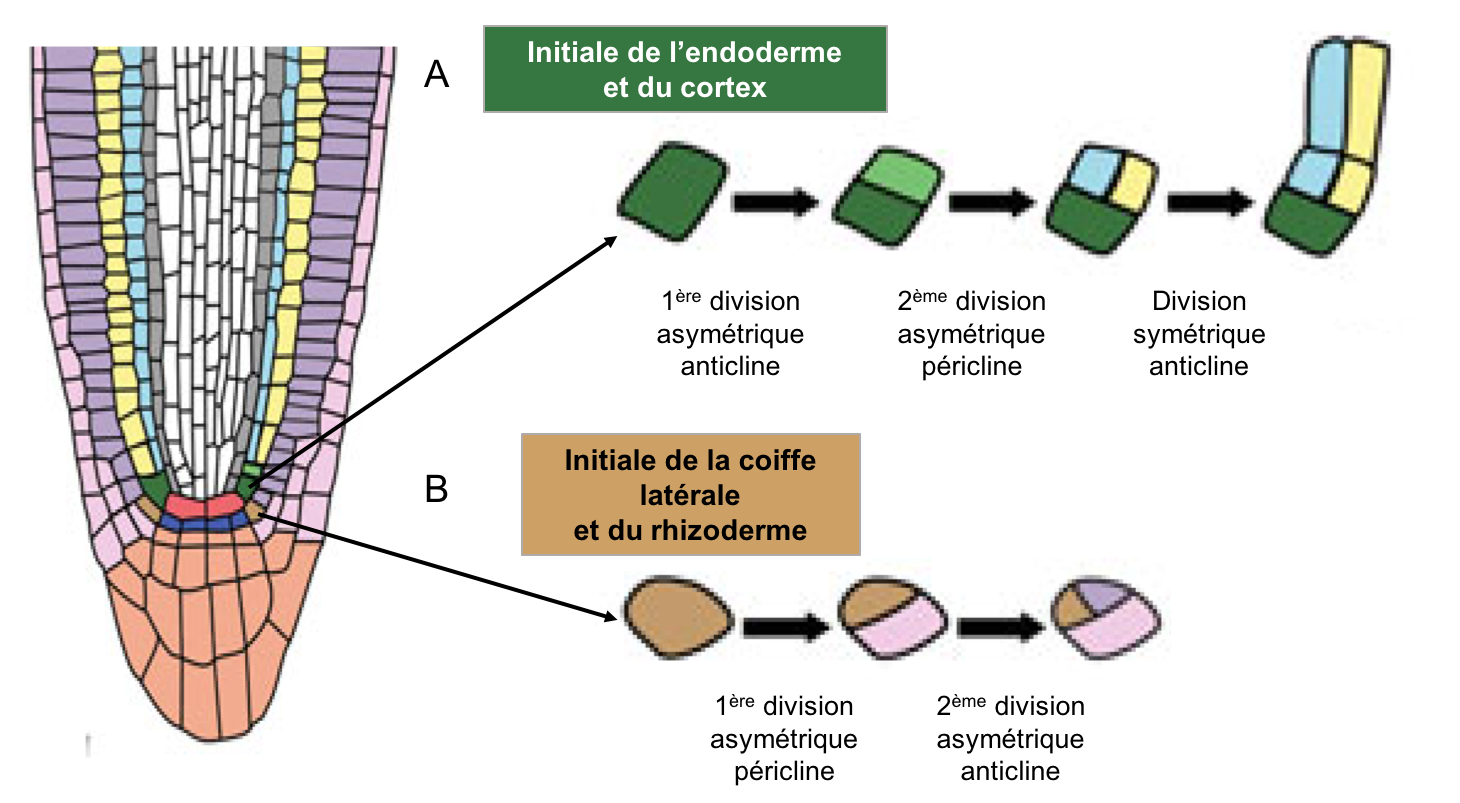
Figure 13 : Exemple de la genèse des cellules corticales et endodermiques (A) et des cellules de la coiffe latérale et du rhizoderme (B) à partir des cellules initiales. Observez (i) la première division asymétrique qui permet l’auto-renouvellement de la cellule souche et (ii) la succession des divisions anticlines (perpendiculaires à l’axe de croissance) ou périclines (parallèles à l’axe de croissance) qui positionne les cellules filles au niveau du tissu qu’elles vont contribuer à former.
Le centre quiescent contrôle le maintien à l’état indifférencié des cellules souches racinaires (les initiales) par contact direct (Figure 14). Il joue donc un rôle de centre organisateur, à l’instar du groupe de cellules exprimant WUSCHEL dans la ZC du MAC. De plus, si les initiales sont endommagées, par destruction physique ou par radiations ionisantes, les cellules du centre quiescent entrent alors en division et produisent de nouvelles initiales : ce centre constitue donc un réservoir de cellules souches. Lorsque la totalité du centre quiescent est détruite par rayonnement laser, certaines cellules, déjà engagées dans une voie de différenciation vasculaire, se dédifférencient et reconstituent un nouveau centre quiescent.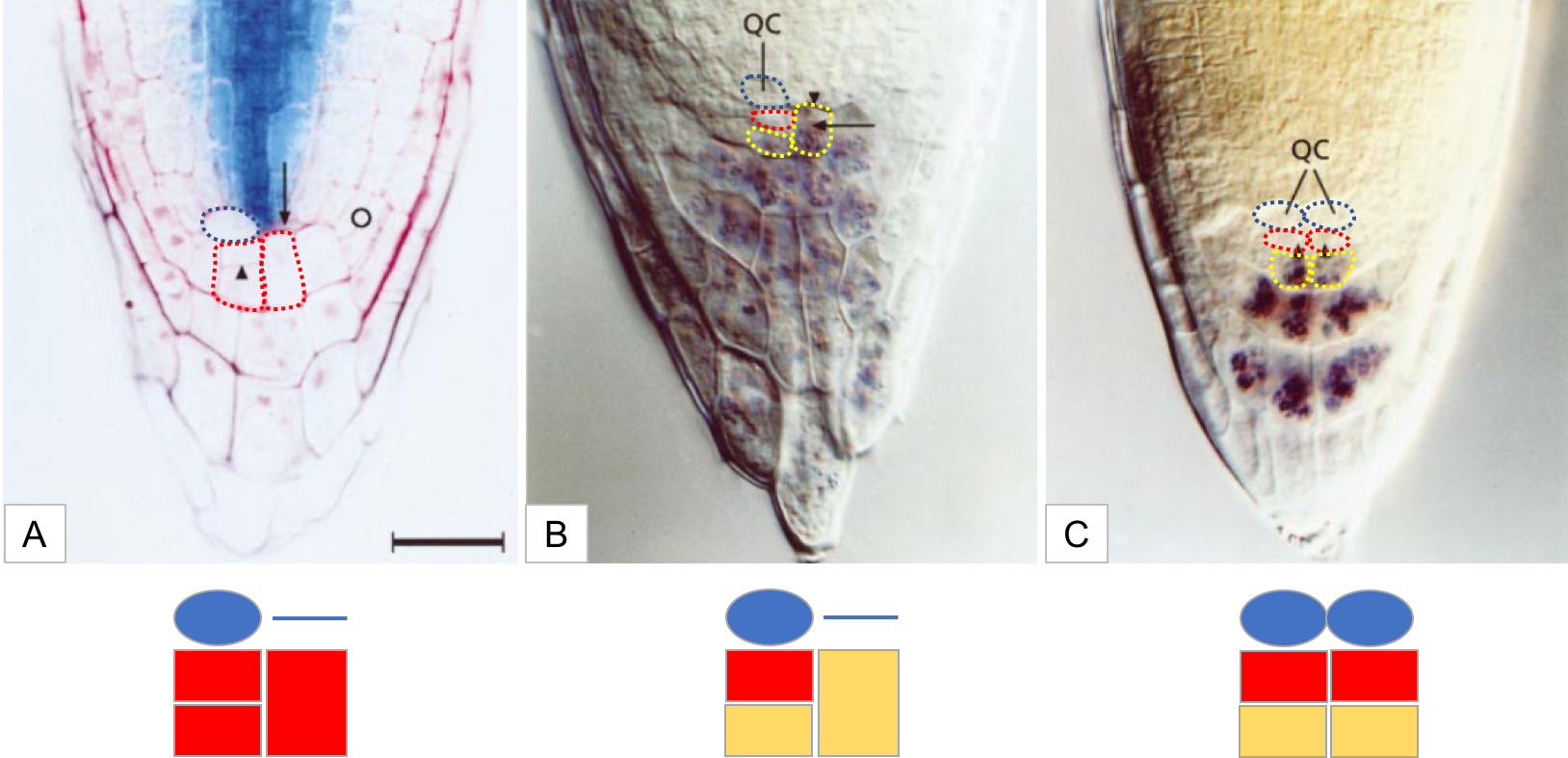
En conclusion : Nous avons vu que les méristèmes apicaux caulinaire et racinaire sont des massifs cellulaires organisés, constitués de cellules souches et de leurs cellules filles qui se divisent activement. Les centres organisateurs (zone d’expression du gène WUS dans le MAC et centre quiescent dans le MAR) maintiennent les cellules souches dans un état indifférencié et contrôlent leur auto-renouvellement en instaurant un micro-environnement (ou niche) favorable. Ces centres organisateurs contrôlent également le nombre de cellules souches au sein du méristème.
Messages principaux à retenir
- Qu’elles soient animales ou végétales, les cellules souches se caractérisent par leur propriété d’auto-renouvellement. Cette propriété est essentielle à leur maintien dans les tissus.
- L’activité des cellules souches adultes chez l’animal et des cellules souches méristématiques chez les végétaux est contrôlée par des signaux (signaux diffusibles ou signaux de contact) émanant de leur niche, c’est à dire le microenvironnement dans lequel elles se trouvent.
- L’activité des cellules souches méristématiques est à l’origine de l’histogenèse et de l’organogenèse continues des végétaux. Chez les animaux, le rôle des cellules souches adultes est essentiellement limité au renouvellement cellulaire pour maintenir l’homéostasie du tissu (équilibre entre perte et production de nouvelles cellules). Dans certains tissus comme le muscle, les cellules souches permettent également de compenser des pertes cellulaires plus importantes après une lésion (phénomène de régénération).
- On note que chez l’homme, diverses pathologies découlent de dysfonctionnement des cellules souches :
