Synthèse 6 : COMPORTEMENTS CELLULAIRES ET CONSTRUCTION DU VÉGÉTAL

Ce cours en ligne synthétique reprend les points de programme suivants :
- Bases mécanistiques de l'élongation des cellules végétales
- Orientation de l'expansion cellulaire : généralités et contrôle
Synthèse 6 : COMPORTEMENTS CELLULAIRES ET CONSTRUCTION DU VÉGÉTAL
Comportements cellulaires et construction du végétal :
EXPANSION CELLULAIRE
(d’après JF. Morot-Gaudry, Dunod ed. )
Source à consulter si besoin : http://univ.scholarvox.com/reader/docid/88841927/page/130
Au cours des synthèses précédentes, vous avez étudié les grands principes de la dynamique et des comportements cellulaires, ces processus étant souvent décrits par défaut au sein du règne animal. Cette synthèse est dédiée à la biologie cellulaire végétale et ses particularités.
Tandis que les cellules animales, délimitées uniquement par une membrane, peuvent parfois être mobiles, les cellules végétales sont entourées d’une paroi rigide composée de microfibrilles de cellulose dans une matrice. Les parois des cellules adjacentes sont solidaires, ce qui interdit tout déplacement des cellules ; la rigidité des parois restreint largement leurs changements de forme. Ces propriétés contraignent fortement la morphogenèse végétale et pourtant, comme chez les animaux, le développement végétal permet la mise en place de tissus et structures aux formes et fonctions variées. Nous verrons dans cette synthèse le rôle fondamental joué par le processus d’expansion cellulaire dans la morphogenèse du végétal.
L’expansion d’une cellule végétale fait intervenir deux composantes :
- L’accroissement de la taille de la cellule
- L’orientation de l’axe de croissance
1 - L’accroissement de la taille cellulaire
L’accroissement en taille d’une cellule végétale résulte de 2 mécanismes qui doivent être coordonnés : augmentation du volume cellulaire et extensibilité de la paroi.
1-1 Augmentation du volume cellulaire
D’un côté, la cellule vivante a une pression interne très forte due à des différences de potentiels hydriques entre l’intérieur et l’extérieur de la cellule. L’eau contenue dans la vacuole engendre une pression de turgescence (comprise en conditions normales entre 3 et 10 bars) qui exerce une force sur la membrane plasmique tendant à repousser les limites de la cellule.
D’un autre côté, la paroi, capable de supporter des tensions pouvant aller jusqu’à 60 bars (12 fois la pression du pneu d’une voiture !) permet de contenir cette pression interne.
Les cellules des tissus jeunes possèdent une paroi très fine et la rigidité de ces tissus est essentiellement tributaire de la pression de turgescence liée à l’apport en eau. Pour preuve, une jeune plante insuffisamment arrosée aura un aspect flétri dû à une perte de rigidité des tissus (Figure 1).
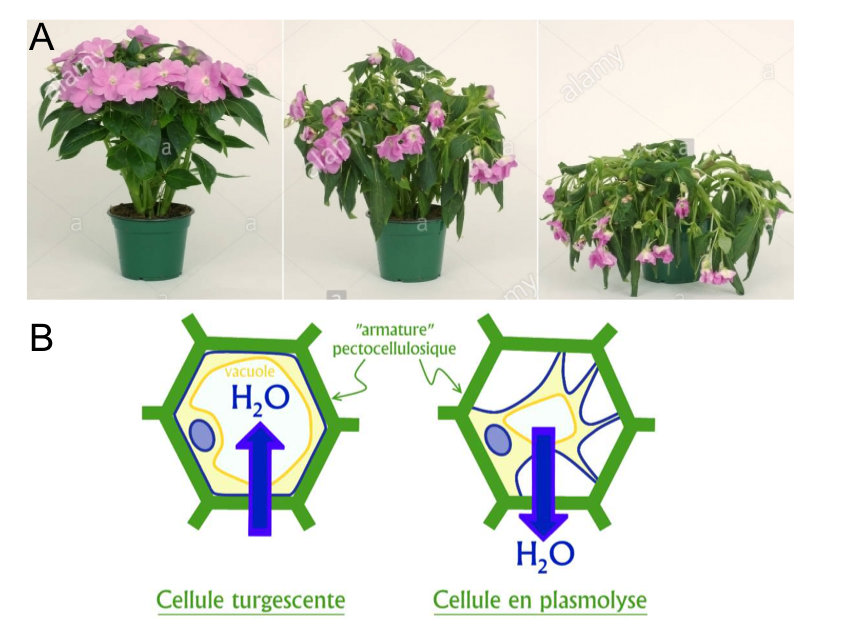
Figure 1 : (A) Exemple de processus de flétrissement lié à un manque d'eau. Source :
Alamy stock photo. (B) Visualisation du processus au niveau cellulaire. Source : https://www.futura-sciences.com/planete/definitions/botanique-turgescence-6313/
1-2 Extensibilité de la paroi
L’extensibilité pariétale est déterminée par la structure même de la paroi, c’est-à-dire par le diamètre, le nombre et l’orientation des microfibrilles, ainsi que par l’interaction entre ces microfibrilles et les constituants de la matrice. Les modifications de pH jouent un rôle primordial dans cette extensibilité pariétale. Depuis les années 70, de nombreuses études tendent à montrer que l’acidification de l’apoplaste induit l’élongation cellulaire et donc la croissance des tissus : c’est la théorie de la croissance acide ou « the acid growth theory » (Rayle, Cleland, 1970). En outre, l’étude de ces processus a permis de mettre en évidence un rôle de l’auxine (Figure 2), dans cette acidification. La théorie de la croissance acide propose donc deux étapes :
(1) L’auxine induit un efflux de protons vers l’apoplaste en agissant sur des pompes à protons transmembranaires.
(2) Cette acidification provoque le relâchement de la paroi.
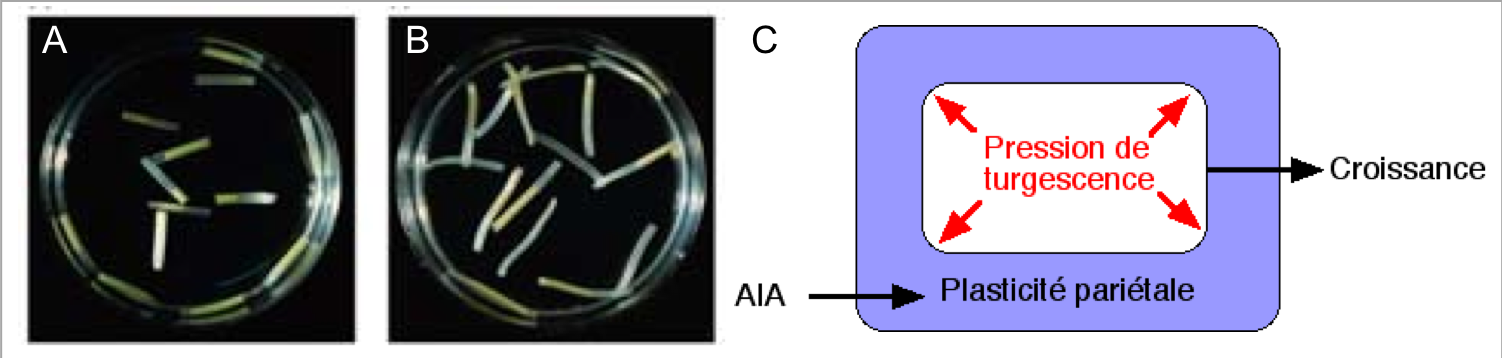
Figure 2 : (A, B) Action de l'auxine sur des fragments d'hypocotyle de tabac incubés en absence (A) ou en présence (B) de 10 mM d'auxine. Observez l’allongement des hypocotyles en présence d’auxine. Des expériences complémentaires montrent que cette croissance dépend de l’élongation des cellules du tissu et non de leurs divisions. (C) Schématisation du processus au niveau cellulaire. Source : http://www.snv.jussieu.fr/bmedia/cell/07schema.htm
La
figure 3A montre comment l’auxine agit sur le pH en modifiant l’activité de
pompes à protons membranaires. Il s’en suit des modifications d’activité de
diverses protéines pariétales (incluant des enzymes) impliquées dans
l’extensibilité de la paroi. L’existence de ces protéines a pu être révélée
grâce à l’expérience suivante : (i) On extrait les protéines présente dans
la zone de croissance de l’hypocotyle ; (ii) On teste individuellement
leur action sur l’élongation de segments d’hypocotyle préalablement
ébouillantés (les protéines endogènes du tissu sont donc inactives car
dénaturées). Il a ainsi été montré qu’une protéine, que l’on nomme « expansine
», est capable d’accroître à elle seule l’extensibilité pariétale, et ce,
d’autant plus efficacement que les conditions de pH sont acides.
Sur la base de ces observations,
l’expansine est considérée comme un facteur clef du relâchement pariétal. Elle agirait
en dissociant les liaisons hydrogènes au sein du réseau cellulose-hémicellulose
contribuant ainsi au réarrangement des polysaccharides (Figure 3B). D’autre
part, l’acidification pariétale provoque également l’activation d’enzymes de
type hydrolases agissant sur le squelette de xyloglucane et conduisant ainsi à
une perte de résistance mécanique de la paroi.
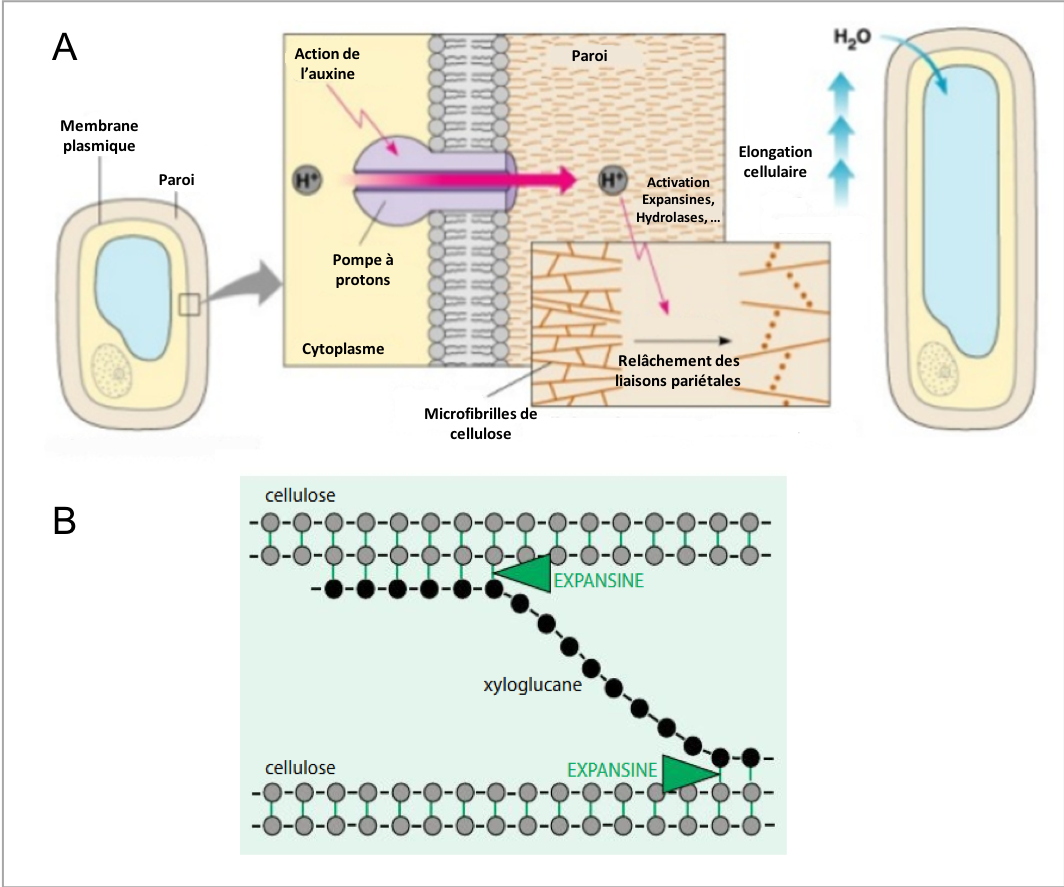
Figure 3 : (A) Théorie de la croissance acide. L’auxine active une pompe à protons transmembranaire ce qui provoque une sortie de protons et donc une acidification de la paroi. La baisse de pH a pour conséquences (i) de déstabiliser les liaisons hydrogènes entre les molécules de cellulose ce qui facilite l’action des expansines, et (ii) d’activer des enzymes de type hydrolases. D’après B. Cummings, Pearson Education. (B) Modèle d'action des expansines. Ces protéines agissent en dissociant les liaisons hydrogènes au sein du réseau cellulose-hémicellulose. Ceci entraîne l’écartement et le glissement des microfibrilles de cellulose.
La croissance de la cellule doit bien sûr s’accompagner de la synthèse de nouveaux constituants pariétaux et de leur incorporation au niveau de la paroi pour permettre à celle-ci de maintenir son épaisseur constante et ainsi préserver son rôle de soutien.2 - L’orientation de l’expansion cellulaire
La cellule végétale est sujette à différents modes de croissance qui déterminent sa forme et sa taille au sein de la plante.
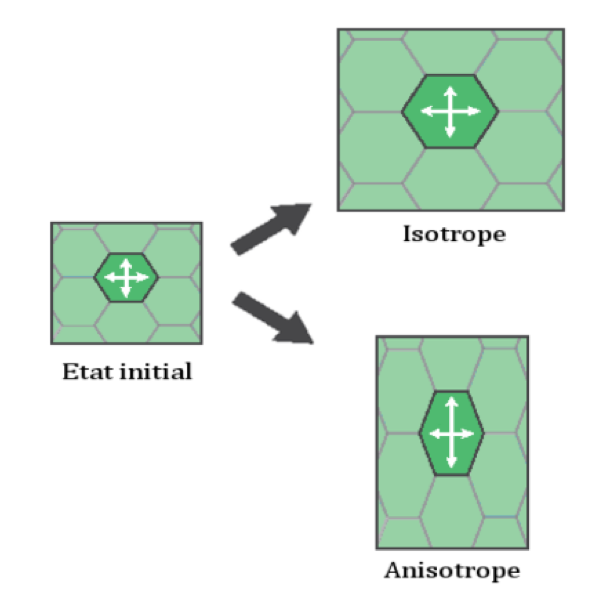
2-1 Croissance isotrope versus anisotrope
On distingue deux types d’expansion cellulaire qui peuvent plus ou moins se combiner au cours de la vie d’une cellule (Figure 4) :
- Lorsque l’expansion cellulaire est équivalente dans toutes les directions, on parle de croissance isotrope. Cette modalité de croissance génère des formes plus ou moins sphériques. Elle est relativement rare au cours du développement des plantes et concerne par exemple les jeunes cellules méristématiques ou encore les grains de pollen (Figure 5A).
- La croissance anisotrope présente quant à elle un axe de croissance préférentiel. C’est la raison pour laquelle, on parle plutôt en général d’élongation cellulaire dans le cas des cellules végétales, correspondant à une expansion cellulaire selon un axe privilégié.
La pression de turgescence constitue le moteur principal de l’expansion cellulaire mais ne joue pas de rôle dans l’orientation de cette expansion. C’est uniquement la paroi qui permet l’orientation de la croissance grâce à des différences locales de plasticité et d’extensibilité.
Ceci peut être démontré par l’obtention de cellules végétales dépourvues de paroi, appelés protoplastes (à ne pas confondre avec les proplastes, jeunes plastes des cellules non différenciées !). Ces derniers sont obtenus en incubant des cellules végétales en présence d’un mélange d’enzymes capables de dégrader les constituants pariétaux (essentiellement des cellulases que l’on peut extraire à partir d’organismes xylophages). Il s’agit d’un état artificiel et transitoire. Dans cet état, la pression de turgescence agit uniformément sur l’ensemble du volume cellulaire : les protoplastes sont sphériques (Figure 5B).
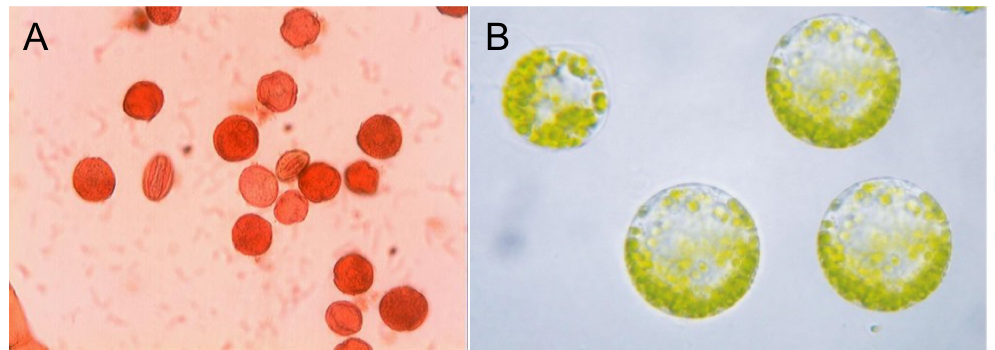
Figure 5 : (A) Protoplaste de mésophylle de feuille de tabac. (B) Grain de pollen de Bouleau colorés à la safranine.
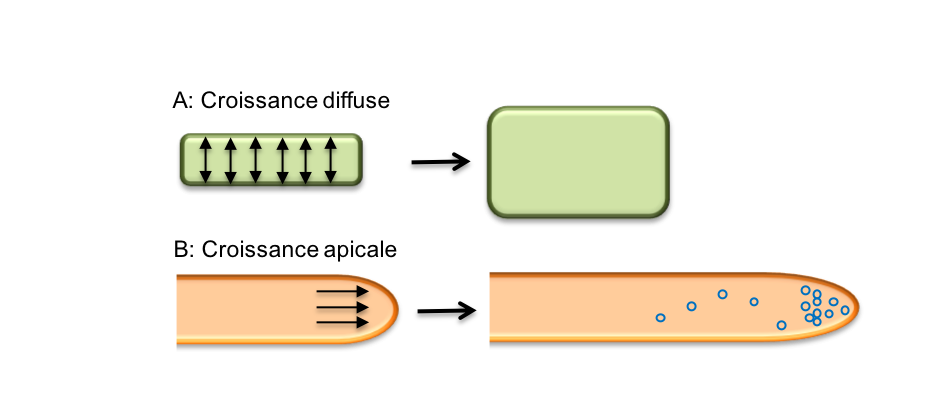
2-2 Croissance apicale versus croissance diffuse
Dans le cas de la croissance
anisotrope, on distingue deux modalités de croissance : la croissance apicale
et la croissance diffuse (Figure 6). La croissance apicale (ou élongation
apicale), située uniquement à un pôle cellulaire conduit à la formation d’une
structure tubulaire qui s’allonge, comme on l’observe dans le cas du poil
absorbant ou du tube pollinique (Figure 6B).
Dans le cas de la croissance diffuse, l’expansion peut affecter toute ou partie
de la cellule (Figure 6A). Cette modalité compte pour
beaucoup dans l’établissement de la forme et de la taille des cellules et donc
de celles des organes.
2-3 Contrôle de l’orientation de l’expansion cellulaire
- Orientation des microfibrilles de cellulose
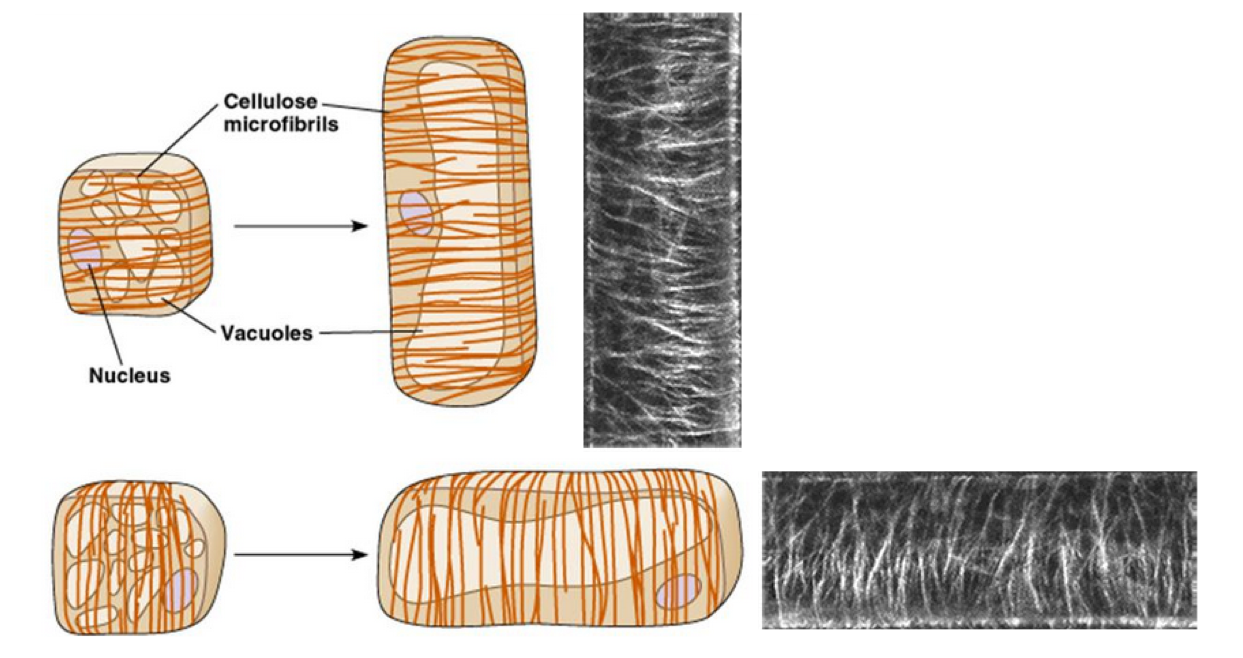
Figure 7 : Orientation des microfibrilles de cellulose perpendiculaire à l’axe d’élongation cellulaire. Les photographies de gauche permettent de visualiser les microfibrilles à la surface cellulaire au niveau des zones encadrées.
- Rôle des microtubules dans la direction de la croissance
Cette
orientation des microfibrilles est étroitement corrélée
à celle des microtubules du cytosquelette intracellulaire. Cette
corrélation a pu être montrée grâce à des expériences de marquage de la tubuline
sur des cellules d’hypocotyle de plantes cultivées soit à l’obscurité (condition
qui favorise l’élongation cellulaire dans le sens de la hauteur), soit à la
lumière (condition qui favorise une croissance des cellules en largeur). On
observe que dans un cas comme dans l’autre, l’orientation des microtubules est
perpendiculaire à l’axe de la croissance, comme observé précédemment pour les
fibres de microcellulose (Figure 8). Il a été récemment démontré un lien de
cause à effet entre ces deux phénomènes : ce sont
les microtubules qui guident l’orientation du dépôt des microfibrilles en interagissant
directement avec les celluloses synthases transmembranaires qui synthétisent la
cellulose.
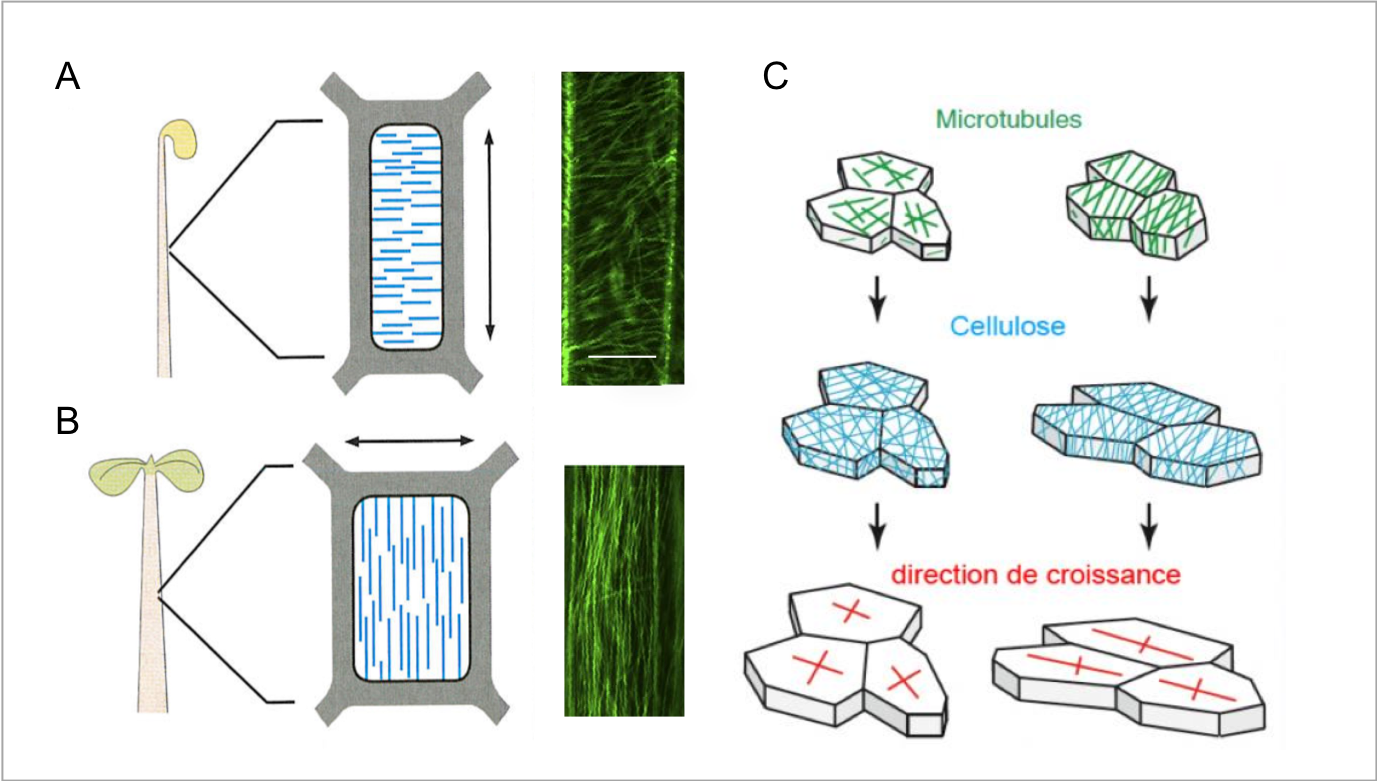
Figure 8 : (A, B) Immunomarquage
de la tubuline. Observer l’organisation du réseau de microtubules au sein de
cellules d’hypocotyles de jeunes plantes cultivées soit à l’obscurité (A)
soit à la lumière (B). Noter leur orientation perpendiculaire à l’axe de
croissance. Barre = 10 mm. (C) Schéma de synthèse : l’orientation des microtubules (en vert) contrôle le dépôt des
microfibrilles de cellulose (en bleu), qui détermine à son tour la direction de
croissance des cellules (en rouge). La pression de turgescence est le moteur
de la croissance, et l’orientation de la cellulose restreint la croissance dans
une direction perpendiculaire aux arceaux de cellulose. Sur le schéma de
gauche, les microtubules ne présentent pas d’orientation préférentielle : les
cellules peuvent grandir dans toutes les directions. À droite, les microtubules
sont globalement parallèles les uns aux autres, ce qui impose aux cellules une
croissance orientée. source : https://planet-vie.ens.fr/article/2519/comment-plantes-acquierent-elles-leur-forme-contribution-signaux-mecaniques
