Synthèse 4 : CONTRÔLE DU CYCLE CELLULAIRE

Ce cours en ligne synthétique reprend les points de programme suivants :
- Contrôle de la succession des phases du cycle par les couples Cycline/CDK
Synthèse 4 : CONTRÔLE ET RÉGULATION DU CYCLE CELLULAIRE
Contrôle et régulation du cycle cellulaire
Source : https://planet-vie.ens.fr/article/1543/regulation-cycle-cellulaire (à lire !!!)
1. Rappels : Les différentes phases et les événements du cycle cellulaire
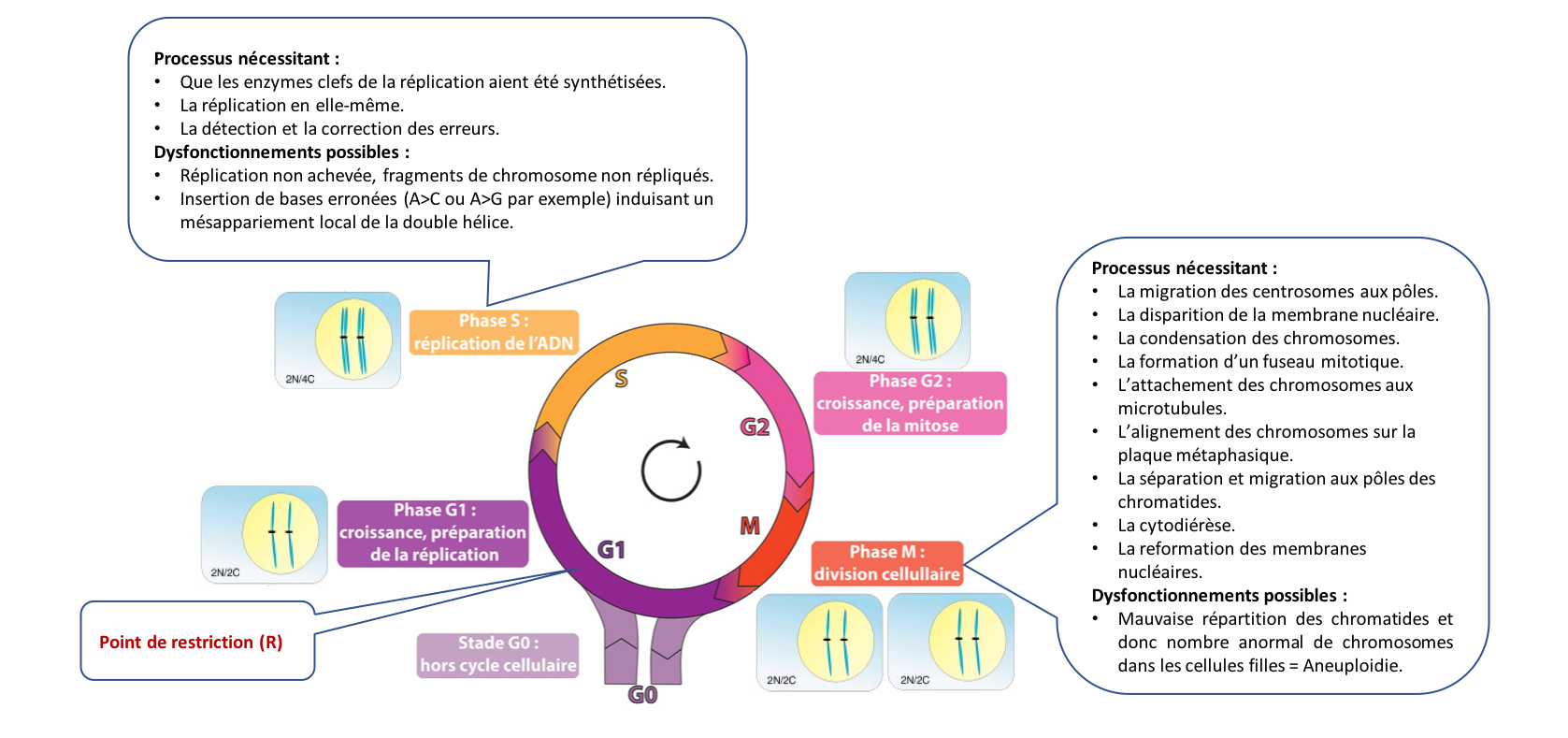
Pour
assurer, d’une part, l’ordre immuable de la succession des quatre phases du
cycle (réalisation de chaque phase et passage d’une
phase à l’autre),
et d’autre part, l’obtention de deux cellules filles identiques
(surveillance du bon déroulement de chaque phase),
la cellule dispose de systèmes de régulation hautement perfectionnés qui font
l’objet de cette synthèse. Nous verrons que le contrôle de la progression dans le cycle cellulaire
fait intervenir des protéines appelées kinases cycline-dépendantes, les CDK. La surveillance du cycle implique quant à elle différents acteurs protéiques
en charge d’arrêter le cycle si l’étape précédente n’est pas terminée, d’enclencher
une « réparation » si nécessaire, voire d’induire la mort de la
cellule si les dommages trop importants. Un intérêt majeur de l’étude de ces processus (outre la compréhension des mécanismes fondamentaux du vivant) réside
dans le fait qu’ils sont souvent dérégulés dans les cancers, entraînant la
prolifération anarchique des cellules. La connaissance de la régulation du
cycle cellulaire est donc fondamentale pour la cancérologie et peut servir à
mettre au point de nouvelles approches thérapeutiques. Elle revêt bie sûr aussi un intérêt fondamental pour la compréhension des processus
2. Comment assurer le déroulement et la succession des 4 phases du cycle ?
2.1 Mise en évidence historique d’un contrôle du cycle cellulaire
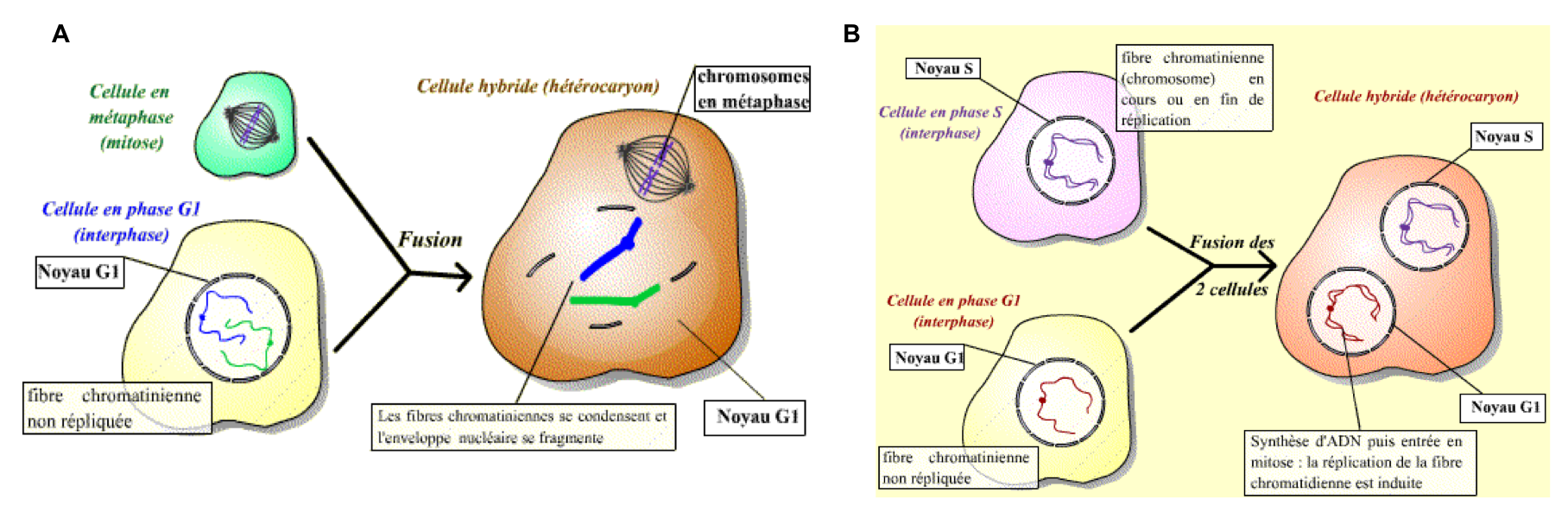
Figure 2 : La fusion de deux cellules à des stades différents du cycle cellulaire produit une cellule hybride avec deux noyaux différents et un cytoplasme (hétérocaryon). (A) Fusion d’une cellule en mitose et d’une cellule en phase G1. On observe que la fusion entre une cellule en mitose (métaphase) et une cellule interphasique (G1, G2 ou S) induit une condensation des chromosomes issus de la cellule en interphase et la disparition de l’enveloppe nucléaire correspondante. (B) Fusion d’une cellule en phase S et d’une cellule en phase G1. La fusion d’une cellule en phase S avec une cellule en phase G1 déclenche la réplication de l’ADN du noyau qui se trouvait initialement en G1. D’après Lebart, Mariani et Furlong 2004 (Biologie et Multimédia).
On peut déduire de ces expériences les informations suivantes :
- Le cytoplasme d’une cellule en métaphase contient un facteur diffusible suffisant pour provoquer la condensation des chromosomes et la rupture de la membrane nucléaire d’un noyau G1. L’activité biochimique mise en évidence ici est appelée MPF (Mitosis Promoting Factor).
- Le cytoplasme d’une cellule en phase S contient un facteur diffusible suffisant pour provoquer la réplication de l’ADN d’un noyau en G1.
Le MPF et le facteur responsable de la transition G1/S sont tous deux des complexes protéiques composés de :
- Une cycline, protéine sans activité enzymatique mais indispensable à l’activité du complexe.
- Une kinase cycline-dépendante nommée CDK (Cyclin Dependent Kinase) qui n’est active qu’associée à la cycline.
2.2 Comment une CDK fonctionne-t-elle ?
Les CDK sont des enzymes de la famille des sérine-thréonine kinases, c’est à dire qu’elles phosphorylent des protéines spécifiques au niveau de résidus sérine ou thréonine (Figure 3). Les protéines cibles vont alors changer de conformation et contribuer au déroulement de la phase du cycle considérée ou à la transition vers la phase suivante (voir ci-après les exemples des transitions G2/M et G1/S).
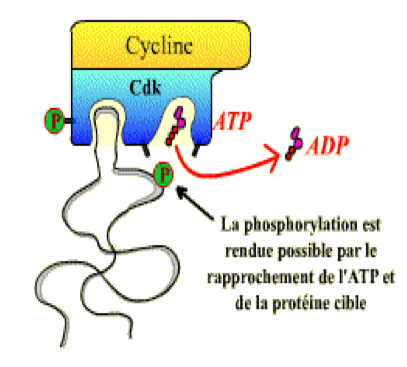
Figure 3 : Représentation schématique de la phosphorylation d’une protéine cible par un complexe Cycline-CDK. La CDK représentée ici a été préalablement activée par phosphorylation.
On notera dès maintenant que l’association à une cycline est nécessaire mais non suffisante à l’activité des CDK. Comme nous le verrons plus loin, ces enzymes sont elles-mêmes régulées par phosphorylation (rôle de kinases spécifiques) ou déphosphorylation (rôle de phosphatases spécifiques) de certains résidus, ou par la liaison d’inhibiteurs spécifiques.2.3 Quelle est la nature des complexes Cycline-CDK impliqués dans la progression du cycle ?
Les CDK et autres protéines impliquées dans la régulation du cycle cellulaire des cellules de mammifères ont été originellement identifiées chez la levure (Saccharomyces cerevisiae et Schizosaccharomyces pombe) grâce au criblage de mutations affectant la prolifération cellulaire. Dans les cellules animales, 6 couples Cycline-CDK intervenant dans un ordre déterminé et contrôlant chacun des étapes précises du cycle cellulaire ont ainsi été identifiés (Figure 4 ; couples à mémoriser).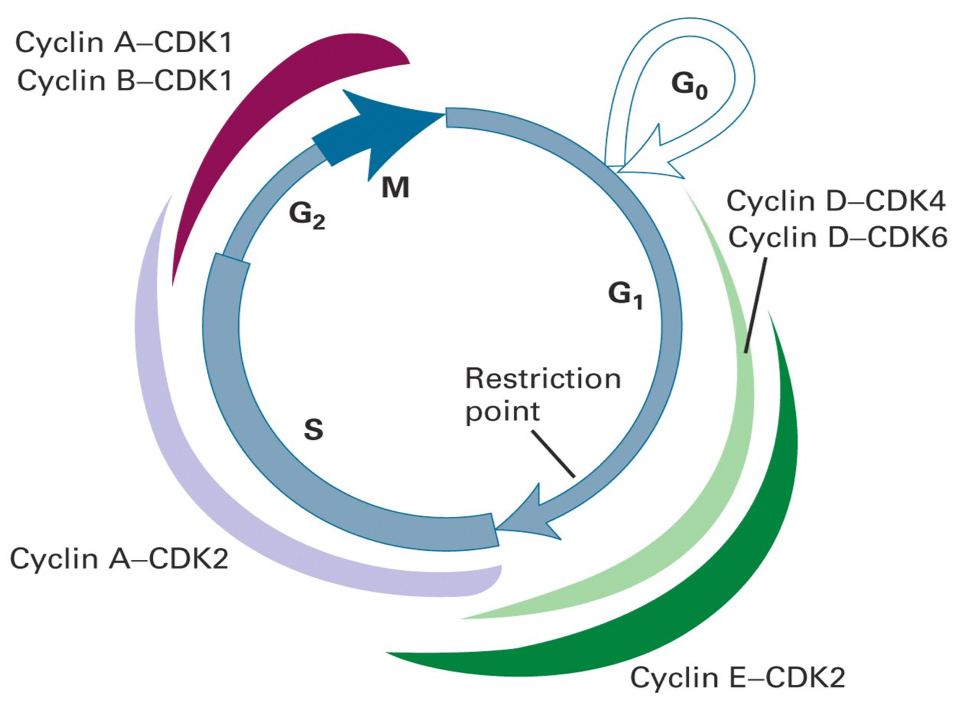
2.4 Comment les activités enzymatiques des complexes Cycline-CDK apparaissent-elles et disparaissent-elles aux moments opportuns ?
Les CDK sont présentes avant qu’elles ne soient requises. Comment leur activité enzymatique apparaît-elle et disparaît-elle aux moments opportuns ?
Trois grands processus interviennent dans cette régulation temporelle :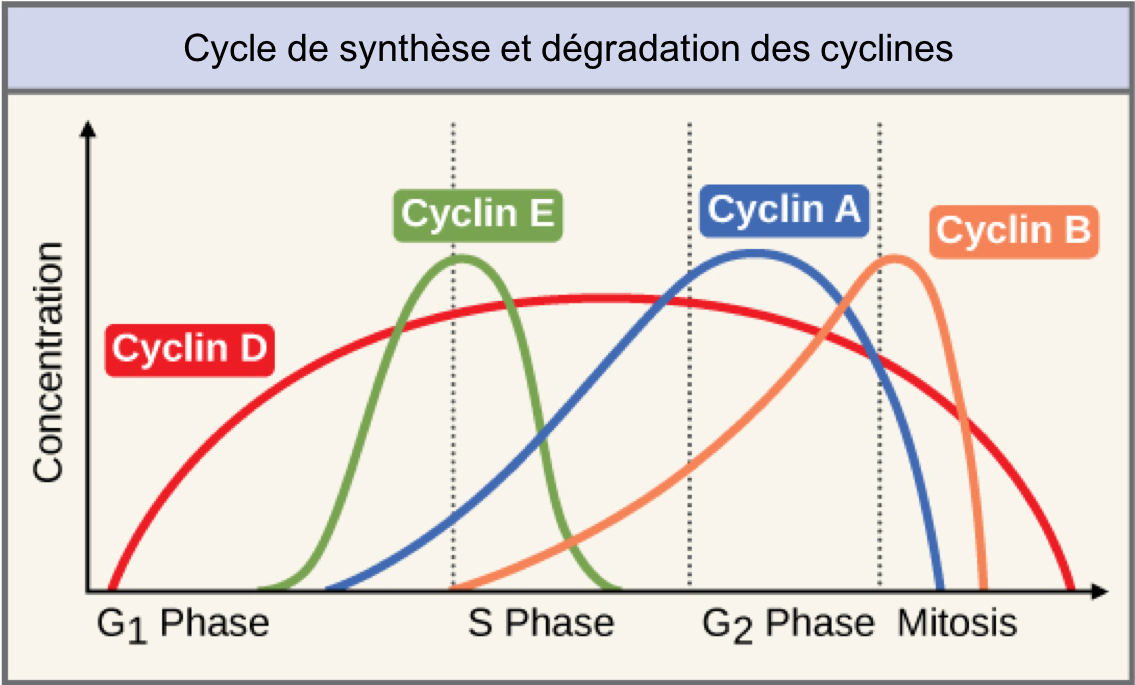
(ii) Les CDK sont régulées par phosphorylation ou déphosphorylation. Ces modifications post-traductionnelles peuvent être activatrices ou inhibitrices selon l’acide aminé modifié (Figure 6).
(iii) Les CDK sont régulées négativement par association physique avec des inhibiteurs nommés CDKI (CDK Inhibitors). Parmi les CDKI figure la protéine p21 (Figure 6).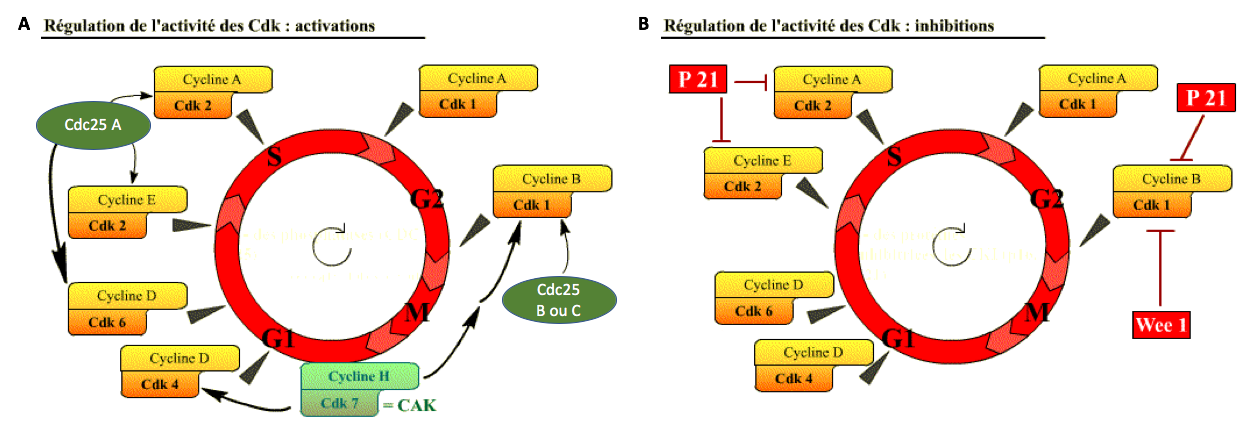
2.5 Exemple 1 : contrôle de la transition G2/M
La transition G2/M nécessite l’activité du couple Cycline B-CDK1. Nous ne verrons pas cette année les détails de l’activation de ce couple Cycline/CDK mais voyons les conséquences de cette dernière.
Une fois actif, le MPF va pouvoir phosphoryler ses substrats. On compte parmi ces derniers :
- Des protéines nucléaires comme les condensines et les Histones H1 et H3. Leur phosphorylation va permettre la condensation des chromosomes en prophase.
- Les lamines nucléaires. La phosphorylation de ces filaments intermédiaires va entraîner la rupture de l’enveloppe nucléaire.
- Des protéines associées aux microtubules (MAPs). Leur phosphorylation va déclencher l’assemblage du fuseau mitotique.
- La protéine APC/C (Anaphase promoting complex). APC/C est une ubiquitine ligase. Une fois activée par le complexe Cycline B-CDK1, elle va ubiquitinyler ses cibles qui seront alors dégradées au sein du protéasome. Ses cibles incluent la cycline B (dont la dégradation permet la sortie de mitose).
2.6 Exemple 2 : Contrôle de la transition G1/S
Nous travaillerons en TD sur le contrôle de la transition G1/S. Lisez ce texte descriptif des événements à l’œuvre que vous aurez à schématiser (à connaître sur bout des doigts !).
Au début de G1, la cellule contient le complexe Cycline D-CDK 4/6. Elle contient également un complexe moléculaire nucléaire composé de la protéine Rb (Retinoblastoma) associée au facteur de transcription E2F. Ce dernier, même fixé à ses séquences régulatrices spécifiques, ne peut pas activer ses gènes cibles tant qu’il est associé à Rb. Le complexe Cycline D-CDK 4/6 une fois activé (par exemple sous l’effet de facteurs extracellulaires mitogènes) initie la phosphorylation de la protéine Rb. La protéine Rb est un des substrats les plus importants pour les Cycline-CDK de la phase G1 chez les mammifères.
La phosphorylation de Rb entraine l'activation de la transcription de gènes codant les protéines indispensables à la synthèse de l’ADN et à la transition G1/S, dont le gène codant une nouvelle cycline, la Cycline E.
Une fois synthétisée, la Cycline E peut alors s’associer avec la kinase CDK2. Or, ce nouveau complexe Cycline E-CDK2 a lui aussi pour protéine cible la protéine Rb qu’il phosphoryle. On est donc en présence d’une boucle de rétro-activation positive permettant l’amplification de la phosphorylation de Rb et la libération de E2F. L’hyperphosphorylation de Rb (sur 14 sites) permet le passage du « point de restriction », moment à partir duquel les cellules peuvent poursuivre leur cycle cellulaire indépendamment de toute influence extérieure.
En fin de phase G1, le facteur E2F stimule la transcription de gènes permettant l'entrée et la progression dans la phase S (cycline A).
3. Comment une cellule en G0 entre-t-elle dans le cycle cellulaire ?
Les cellules qui sont en G0 n’effectuent ni réplication d’ADN, ni mitose, leur cytoplasme ne contient pas de cycline et le facteur de transcription E2F y est maintenu inactif par la protéine Rb. Ces cellules sont en dehors du cycle cellulaire mais elles peuvent, si elles sont stimulées par des facteurs mitogènes extérieurs, y entrer à nouveau.
La transition de l’état de repos vers la prolifération est
dépendante de l’action de signaux paracrines
(facteurs de croissance) ou endocrines. Ces derniers, en se fixant à leurs récepteurs, vont
activer des voies de signalisation aboutissant notamment à la transcription de
la cycline D (Figure 7).
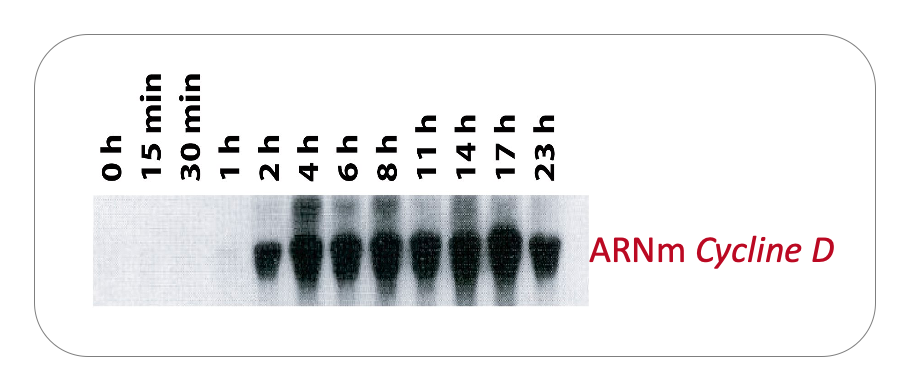
Figure 7 : Induction de la transcription du gène codant la Cycline D dans des macrophages quiescents stimulés par le facteur de croissance CSF1 (Colony Stimulating Factor 1). L’analyse est réalisée par Northern-blot sur des ARN extraits à différents temps après ajout du facteur de croissance au milieu de culture des cellules. Notez que les ARNm codant la Cycline D sont initialement absents (cellules quiescentes). Leur transcription débute après environ 2h de traitement au CSF1 (les cellules rentrent alors en G1).
4. Comment surveiller le bon déroulement du cycle et empêcher sa
progression en cas de problème ?
4.1 Généralités
Au contrôle de la succession des quatre phases du cycle par les CDK, s’ajoutent des mécanismes de surveillance permettant la vérification d’aspects fondamentaux du cycle. Les principaux « checkpoints » sont les suivants (Figure 8A) :
- Un point de contrôle en G1 (point de restriction) visant à s’assurer que toutes les conditions nécessaires à l’entrée dans le cycle sont réunies (comme une taille suffisante des cellules).
- Le DNA Damage Checkpoint (DDCP) en phase S, visant à vérifier l’état des molécules d’ADN avant, pendant et après leur réplication.
- Le Replication Checkpoint (RCP) en G2 visant à vérifier l’achèvement total de la réplication avant l’entrée en mitose.
- Le Mitotic Checkpoint (MPC) en M visant à vérifier l’assemblage correct du fuseau mitotique et le bon positionnement de tous les chromosomes sur la plaque métaphasique avant la séparation des chromatides-sœurs.
Chaque checkpoint implique des protéines en charge de détecter le problème, des protéines en charge de transduire le signal « problème » et des protéines effectrices dont l’action va permettre de bloquer temporairement le cycle pour permettre la réparation ou induire la mort des cellules (Figure 8B).
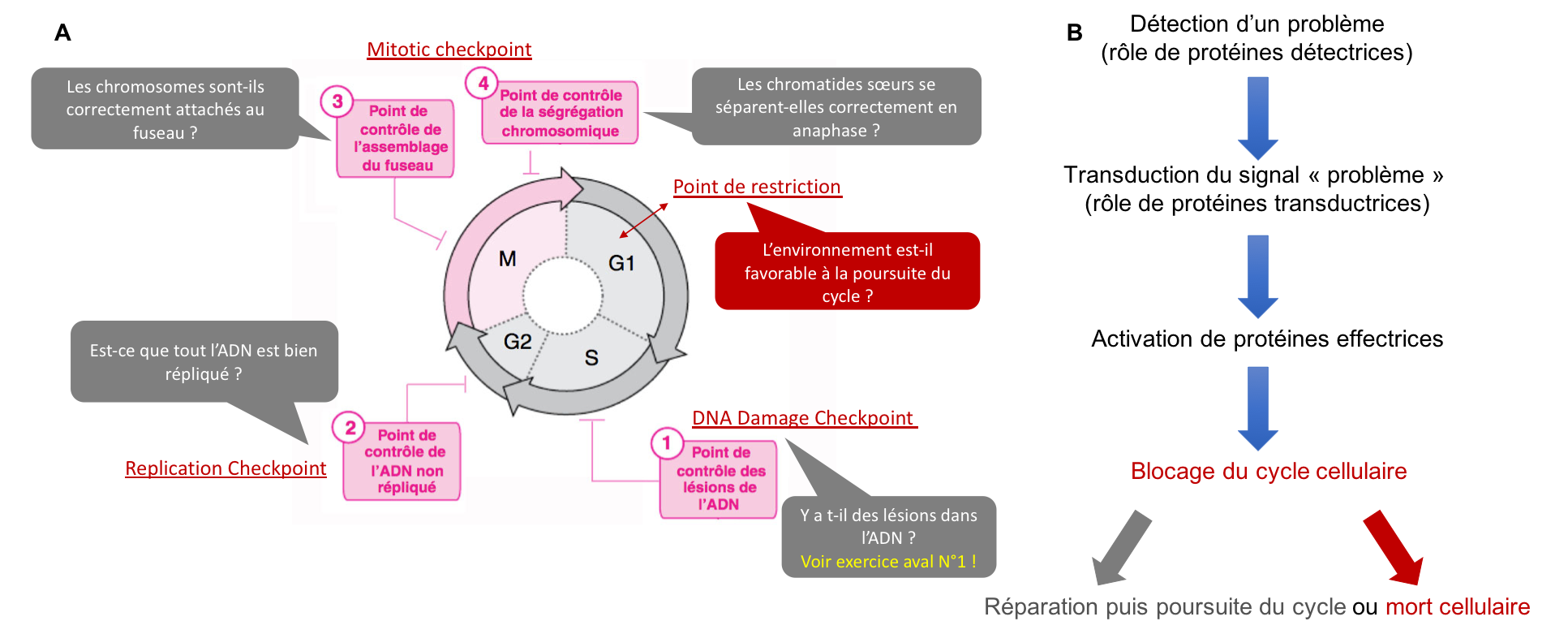
Figure 8 : (A) Les points de contrôle du cycle cellulaire et leurs rôles. (B) Représentation schématique de la cascade moléculaire à l’œuvre depuis la détection d’un problème jusqu’à son règlement (par réparation ou induction de la mort de la cellule).
4.2 Focus sur la protéine p53, gardien du génome.
- Parmi les acteurs jouant un rôle crucial dans la surveillance du cycle cellulaire figure la protéine p53, surnommée « le gardien du génome ». C’est une protéine nucléaire qui possède plusieurs fonctions. C’est un facteur de transcription, mais elle peut aussi stimuler des endonucléases et participer ainsi à la réparation de l’ADN. Elle est exprimée tout au long du cycle cellulaire, mais son taux d’expression reste bas du fait de sa dégradation rapide.
- De nombreux types de stress sont capables d’activer la p53 comme les lésions de l’ADN ou des défauts de division. La détection de ces stress va conduire à des modifications post-traductionnelles de la p53 dont des phosphorylations activatrices.
- Activée, la p53 peut alors jouer son rôle et notamment activer la transcription de gènes cibles. Ceci conduit à deux résultats : soit l’arrêt du cycle cellulaire soit l’apoptose. L’arrêt du cycle cellulaire permet à la cellule de stimuler ses mécanismes de réparation (certains sont directement activés par p53). Lorsque la réparation est effectuée, le taux de p53 retourne à la normale et le cycle cellulaire reprend. Si les dommages subis par la cellule ne peuvent pas être réparés, la cellule entre en apoptose, ce qui conduit à son élimination. Ce mécanisme apoptotique est directement contrôlé par p53.
4.3 Exemple du point de surveillance des lésions de l’ADN (DNA Damage Checkpoint)
Le DNA damage Checkpoint vise à bloquer la transition G1/S si des dommages de l’ADN sont repérés. Il fait intervenir la p53 (Figure 9).
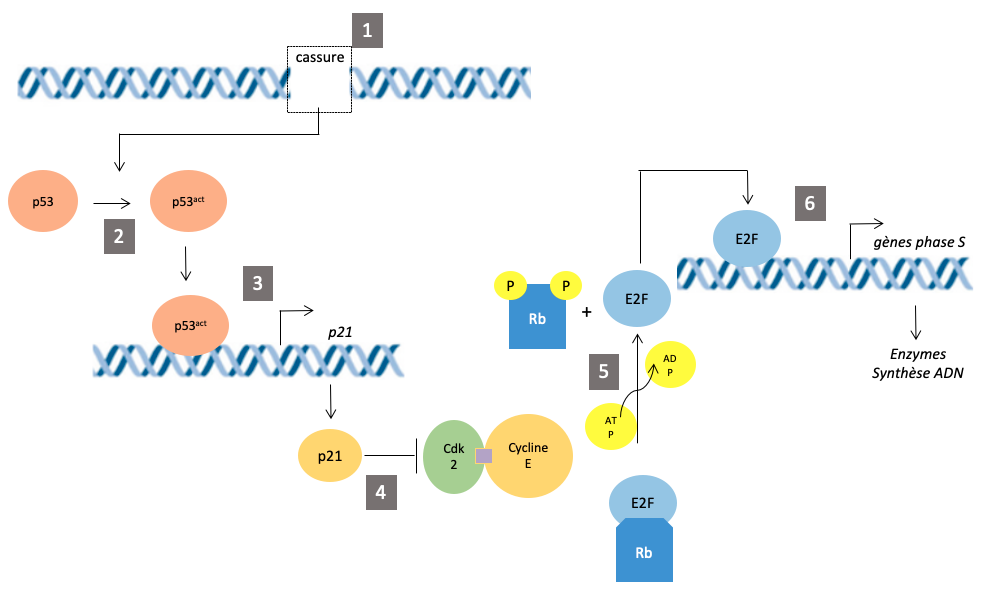
Figure 9 : Blocage de la
transition G1/S suite à la détection de dommages de l’ADN. (1) Des
cassures de l’ADN sont détectées. (2) Ceci
active une voie de transduction conduisant à l’activation de la protéine p53
(par phosphorylation grâce à une kinase spécifique; ce n’est pas représenté).
La protéine p53 activée peut alors se fixer à l’ADN et induire la transcription
de ses gènes cibles. (3) Elle
active notamment la transcription du gène p21. (4) Après traduction, la protéine p21 (un CDKI) inhibe
le complexe Cycline E/Cdk2. (5) En
l’absence de complexe Cycline E/Cdk2 actif, la protéine Rb n’est plus
phosphorylée et maintient donc son interaction avec le facteur de transcription
E2F. (6) Associé à Rb, E2F est
inhibé. Il ne peut donc plus induire la transcription des gènes de la phase S.
La transition G1/S est bloquée.
Pour finir, regardez ce petit film qui résume l’importance des systèmes de surveillance du cycle cellulaire et montre ce qu’il advient lorsqu’ils sont défaillants.
