Synthèse 2 : INTERACTIONS CELLULAIRES
 Ce cours en ligne synthétique reprend les points de programme suivants :
Ce cours en ligne synthétique reprend les points de programme suivants :
- Adhérence cellulaire dans les tissus animaux
- Bases de la communication intercellulaire chez les animaux et les végétaux
Synthèse 2 : INTERACTIONS CELLULAIRES
Interactions cellulaires
Les cellules des organismes pluricellulaires adultes sont organisées en ensembles coopératifs appelés tissus. L’intégrité et le bon fonctionnement tissulaires dépendent étroitement des contacts que les cellules établissent entre-elles et avec la matrice extracellulaire, de la possibilité d’échanger des molécules au sein du tissu et de la réception d’informations en provenance de cellules situées à proximité ou à distance. Au cours du développement, ces processus jouent également un rôle crucial. Les cellules embryonnaires voient leur comportement (se diviser, acquérir ses fonctions, croître, migrer, survivre...) modulé en fonction des signaux qu’elles reçoivent. Elles doivent aussi établir entre elles des jonctions intercellulaires pour former les futurs tissus adultes.
Dans cette synthèse, nous décrirons les acteurs moléculaires et les différents types de jonctions qui concourent à l’adhérence des cellules entre elles. Nous poserons ensuite les bases de la communication intercellulaire, dont nous reverrons l’importance pour l’organisme en développement au cours des synthèses 6 à 9.
Adhérence cellulaire dans
les tissus animaux
Généralités
Nous avons vu en synthèse 1 l’importance que revêt la paroi pour structurer l’architecture des tissus végétaux (voir aussi synthèse 6). Cette paroi constitue le « ciment » qui relie les cellules entre elles. La situation est différente dans les cellules animales. Leur adhérence entre elles ou avec la matrice dépend de molécules transmembranaires spécifiques à chaque type cellulaire, qui peuvent dans certains tissus se regrouper pour former des jonctions.
Commencer par visionner ces deux petits films qui introduisent ces notions :
Les acteurs moléculaires des interactions cellule-cellule et cellule-matrice dans les cellules animales
De nombreuses protéines participent à l’adhérence cellule-cellule ou cellule-matrice mais nous nous focaliserons sur deux types fondamentaux : les cadhérines pour l’adhérence cellule-cellule et les intégrines pour l’adhérence cellule-matrice. Nous verrons plus loin qu’au-delà de leur rôle dans l’adhérence, ces protéines sont également impliquées dans la communication de cellule à cellule ou entre les cellules et leur matrice.
Les cadhérines (Figure 1) :- Sont des glycoprotéines transmembranaires impliquées dans les interactions cellules-cellules.
- Elles lient le calcium et sont dépendantes de ce dernier pour exercer leur fonction.
- Elles interagissent entre elles de cellule à cellule via leur domaine extracellulaire (N-terminal). Elles établissent généralement des liaisons homophiles entre elles (interaction de deux cadhérines identiques) et plus rarement hétérophiles (interaction de deux cadhérines différentes).
- Elles interagissent avec le cytosquelette via leur domaine intracellulaire (C-terminal). Elles participent donc à relier les cytosquelettes de 2 cellules voisines.
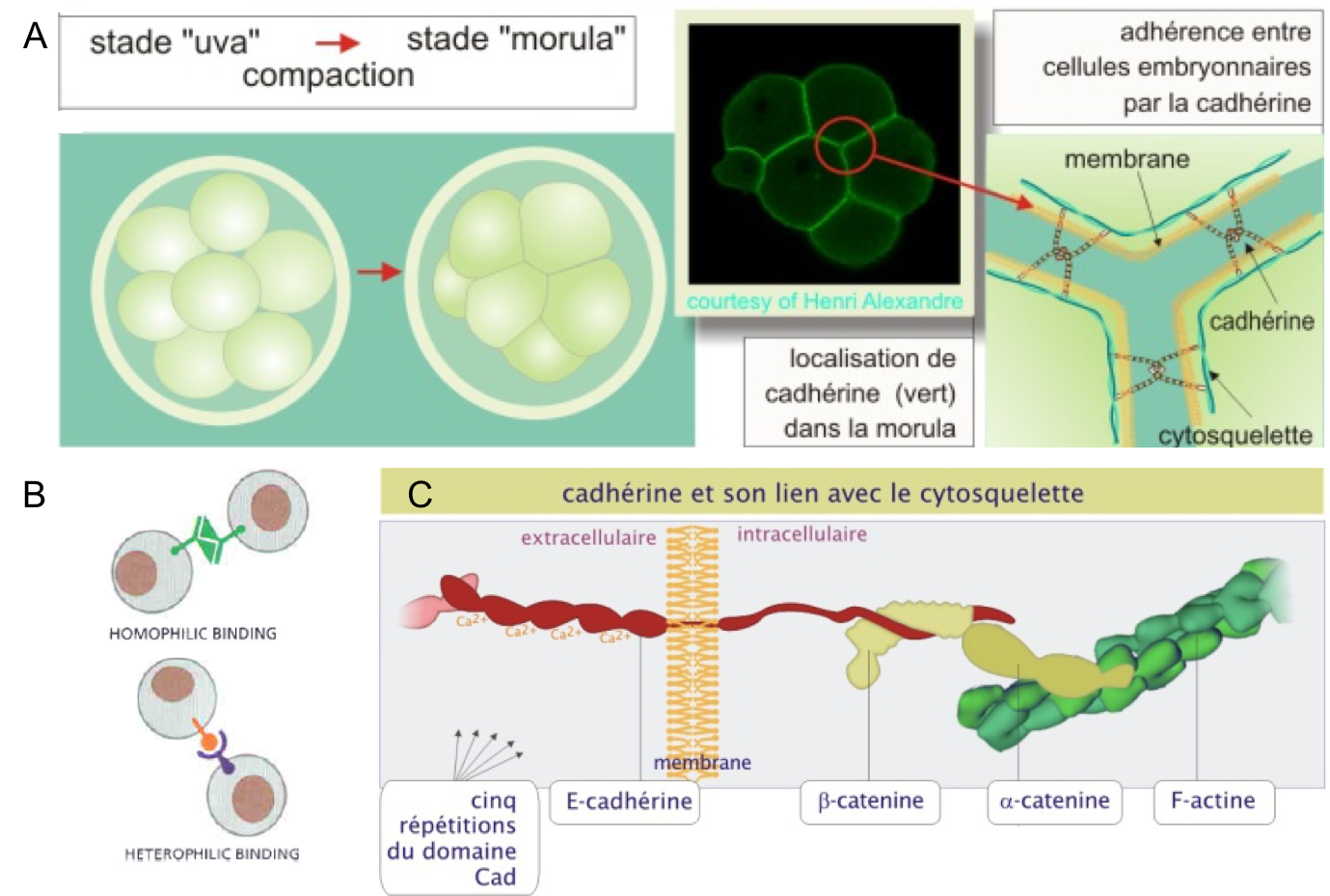
Figure 1 : Les cadhérines. (A) Expression de la E-cadhérine
dans l’embryon de souris au stade 8 cellules. À ce stade les cellules se
compactent entre elles. Observer l’expression de la cadhérine dans les zones de
contacts intercellulaires. (B) Interactions homophiles et hétérophiles des
cadhérines entre elles. (C) Structure des cadhérines. Observer comment la
région intracellulaire lie le cytosquelette d’actine via deux protéines de pontage, la β-caténine et l’α-caténine. Source : http://ressources.unisciel.fr/biocell/chap3/co/module_Chap3_3.html
- Sont les molécules d'adhérence les plus
impliquées dans l'interaction avec la matrice extracellulaire.
- Elles sont composées de deux sous-unités transmembranaires associées de façon non covalente que l'on appelle sous-unités α (α1, 2, 3...) et β (β1, 2, 3...). À ce jour on a découvert 18 sous-unités α et 8 sous-unités β différentes, pouvant former 24 couples (dimères) αβ fonctionnels.
- Elles interagissent avec des protéines matricielles comme la fibronectine ou la laminine (avec des affinités dépendant de la nature du dimère αβ) via leur domaine extracellulaire (N-terminal).
- Elles s’assemblent en amas au niveau des zones d’interaction avec la matrice, formant des structures appelées « point focaux d'adhérence ».
- Elles interagissent avec le cytosquelette via leur domaine intracellulaire (C-terminal). Elles participent donc à relier la matrice au cytosquelette.
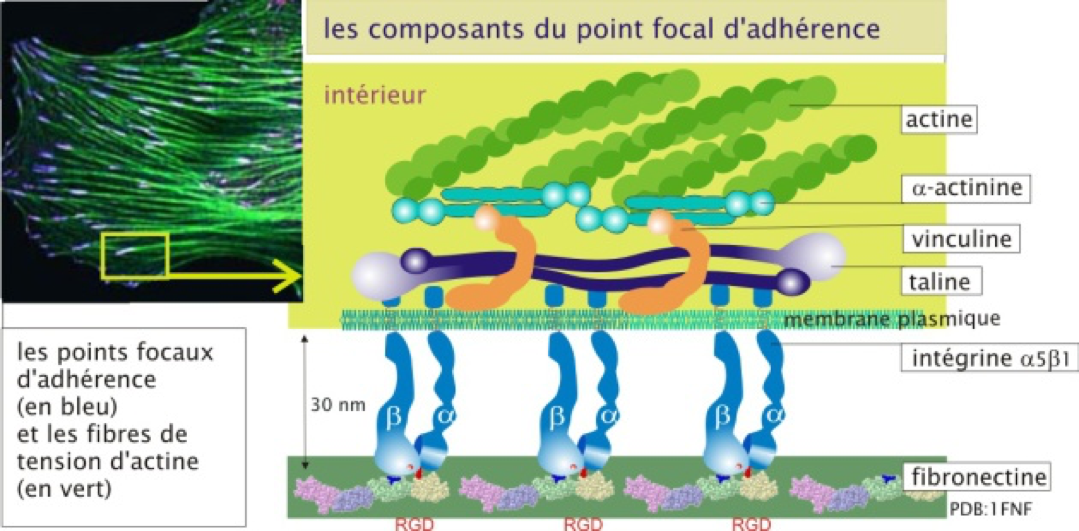
Figure 2 : Les intégrines. Observer la liaison du domaine extracellulaire à la fibronectine et celle du domaine intracellulaire au cytosquelette d’actine via diverses molécules de pontage. Source : http://ressources.unisciel.fr/biocell/chap3/co/module_Chap3_10.html
Les différents types de jonctions établies par les cellules animales
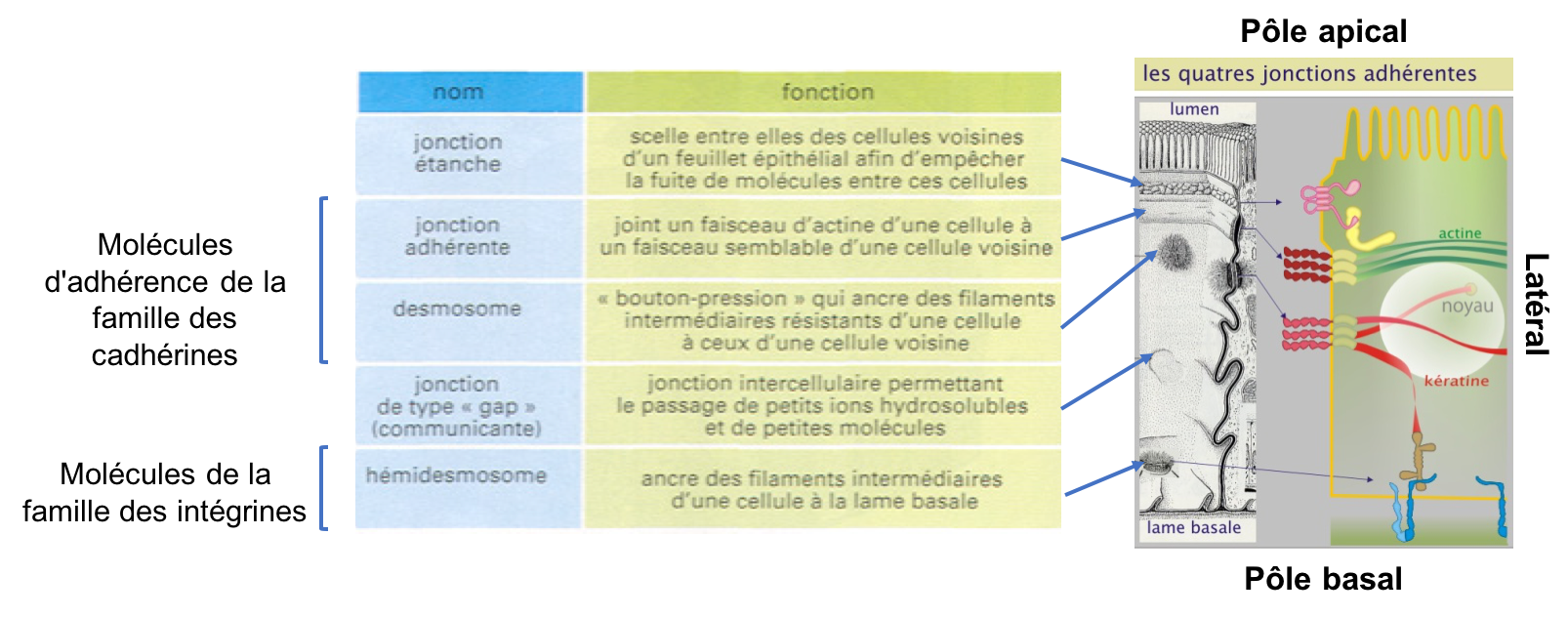
La structure tissulaire est activement maintenue par un principe d'affinité entre cellules. Les molécules d'adhérence forment la base de cette affinité spécifique. Les tissus conjonctifs d'une part, et épithéliaux d'autre part, représentent deux extrêmes dans lesquels la matrice et les systèmes d'adhérence intercellulaire jouent des rôles structuraux complètement différents. Dans les tissus conjonctifs (ou leur version embryonnaire appelée « tissu mésenchymateux »), la matrice extracellulaire est abondante et supporte la plus grande partie des tensions auxquelles les tissus sont soumis. Les interactions entre cellules sont limitées, rendant possible leur déplacement. En revanche, dans les épithéliums (qui tapissent toutes les cavités et les surfaces externes du corps), les cellules sont étroitement associées en feuillets. La matrice extracellulaire est peu abondante, constituant une couche fine, la lame basale, sous-jacente aux cellules. Les cellules elles-mêmes, plutôt que la matrice, subissent la plus grande partie des tensions. C'est grâce aux jonctions cellulaires spécialisées que l'épithélium est suffisamment résistant pour constituer une barrière capable de séparer deux compartiments et que les cellules demeurent immobiles relativement à l’environnement local.
Les différents types de jonctions que l’on trouve dans un épithélium, peuvent être classées d’après leur ultrastructure et leur fonction (Figure 3). On distingue :
- Les jonctions étanches ou "serrées" (jonctions septées chez les invertébrés) qui assurent l’étanchéité du tissu. Elles constituent un rapprochement étroit et localisé des membranes de deux cellules voisines qui limite considérablement le passage des solutés par l'espace intercellulaire.
- Les jonctions d'ancrages qui assurent la liaison mécanique cellule-cellule (jonctions adhérentes et desmosomes) et cellule-matrice (hémi-desmosomes). Elles permettent à des groupes de cellules d'agir comme des unités structurales solides en associant les éléments du cytosquelette d'une cellule à ceux d'une autre ou d’une cellule avec la matrice.
-
Les jonctions communicantes (jonctions Gap) qui autorisent
les mouvements de petites molécules de cellule à cellule (signaux chimiques ou
électriques).
Bases de la communication intercellulaire
Généralités : les acteurs de la communication intercellulaire
Commencez par regarder cette vidéo introductive :
- La communication repose sur deux partenaires : un groupe de cellules « émettrices » d’un signal et des cellules « réceptrices ».
- La nature des signaux est variable : il peut s’agir de neurotransmetteurs (chez les animaux), d’hormones, de cytokines, de facteurs de croissance ou encore de composants de la matrice extracellulaire. Ces signaux peuvent être de nature protéique ou peptidique (donc codés par des gènes) mais pas uniquement. Par exemple, les hormones stéroïdes des animaux sont synthétisées à partir du cholestérol et l’auxine, hormone fondamentale chez les végétaux, est de l’acide indole 3-acétique (AIA), synthétisé à partir du tryptophane.
- Le signal est perçu grâce à des récepteurs protéiques qui peuvent être situés à la surface des cellules cibles (récepteurs transmembranaires en charge de la réception des signaux de nature hydrophile, ne pouvant pas librement passer les membranes) ou à l’intérieur de la cellule (récepteurs en charge de la réception des signaux de nature hydrophobe, pouvant traverser librement les membranes ; cas des récepteurs aux hormones stéroïdes chez les animaux ou du récepteur TIR1 de l’auxine chez les végétaux).
- La fixation du ligand sur son récepteur (fixation spécifique et réversible) active une voie de signalisation à l’intérieur de la cellule cible par un processus appelé « transduction du signal » (« transduire » signifie « passer à travers » ; Figure 4). Cette transduction fait intervenir des molécules signalétiques intracellulaires ou seconds messagers qui, une fois activés, vont modifier l’activité de protéines effectrices (pouvant être des enzymes) en charge de moduler le métabolisme de la cellule, l’organisation cytosquelettique et/ou l’expression génique. Il en résulte des modifications du comportement/propriétés/fonctions cellulaires, lentement ou rapidement, durablement ou transitoirement.
- Toutes les cellules ne sont pas aptes à répondre à n’importe quel signal. Une cellule capable de répondre est dite « compétente ». La compétence repose sur le fait d’exprimer les récepteurs et les différentes molécules signalétiques intracellulaires.
- La réponse de la cellule peut dépendre de la concentration du signal, de la durée d’exposition à ce dernier, du contexte dans lequel la cellule se trouve (contact ou pas avec une matrice ; présence simultanée d’autres signaux...) et de la nature de la cellule elle-même. Deux cellules différentes peuvent répondre de façon radicalement opposée au même couple ligand-récepteur.
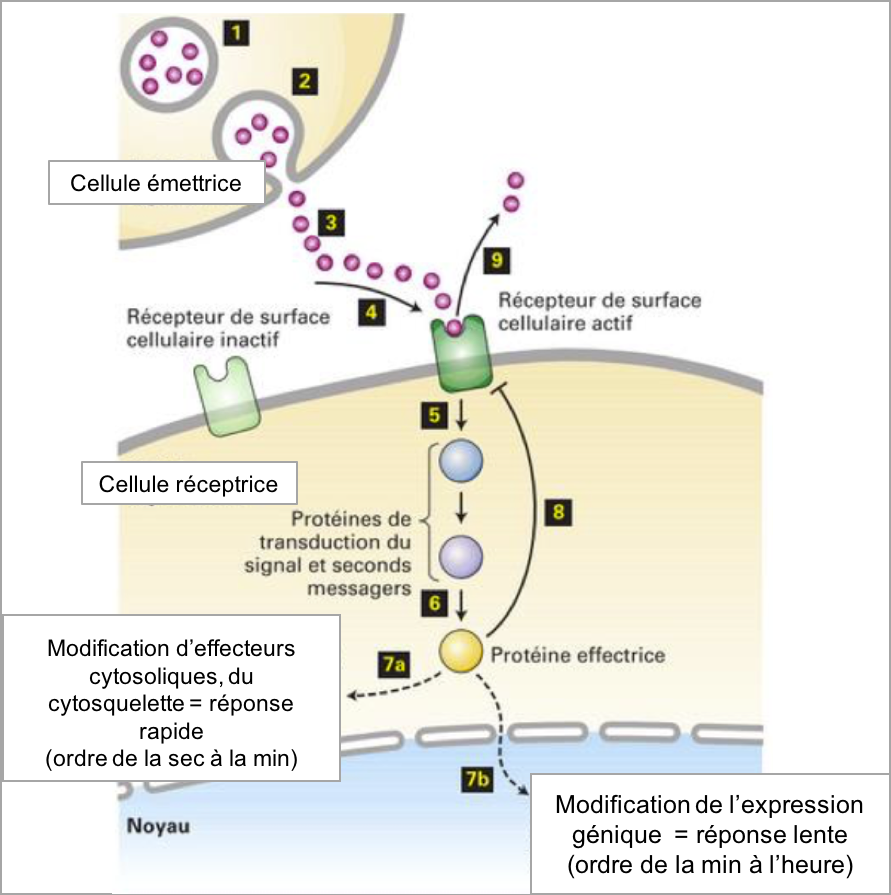
Figure 4 : Principe général de la transduction du signal. 1-2 : sécrétion d’un ligand ; 3-4 : fixation spécifique et réversible du ligand à son récepteur ; 5-6 : activation d’une voie de signalisation intracellulaire ; 7a-7b : déclenchement de la réponse cellulaire par des protéines effectrices ; 8-9 : rétrocontrôle négatif d’un effecteur sur l’interaction ligand-récepteur (moyen de limiter dans le temps l’effet du ligand).
Introduction à la signalisation intracellulaire
On retiendra que parmi les acteurs classiquement rencontrés dans les voies de signalisation intracellulaires, figurent des kinases (enzymes catalysant la phosphorylation de leur substrat i.e. l’ajout d’un groupement phosphate) et des phosphatases (enzymes catalysant la déphosphorylation de leur substrat i.e. l’hydrolyse d’un groupement phosphate). Activées par des récepteurs (comme les récepteurs aux facteurs de croissance), ces enzymes peuvent moduler l’activité de protéines effectrices par phosphorylation ou déphosphorylation (Figure 5).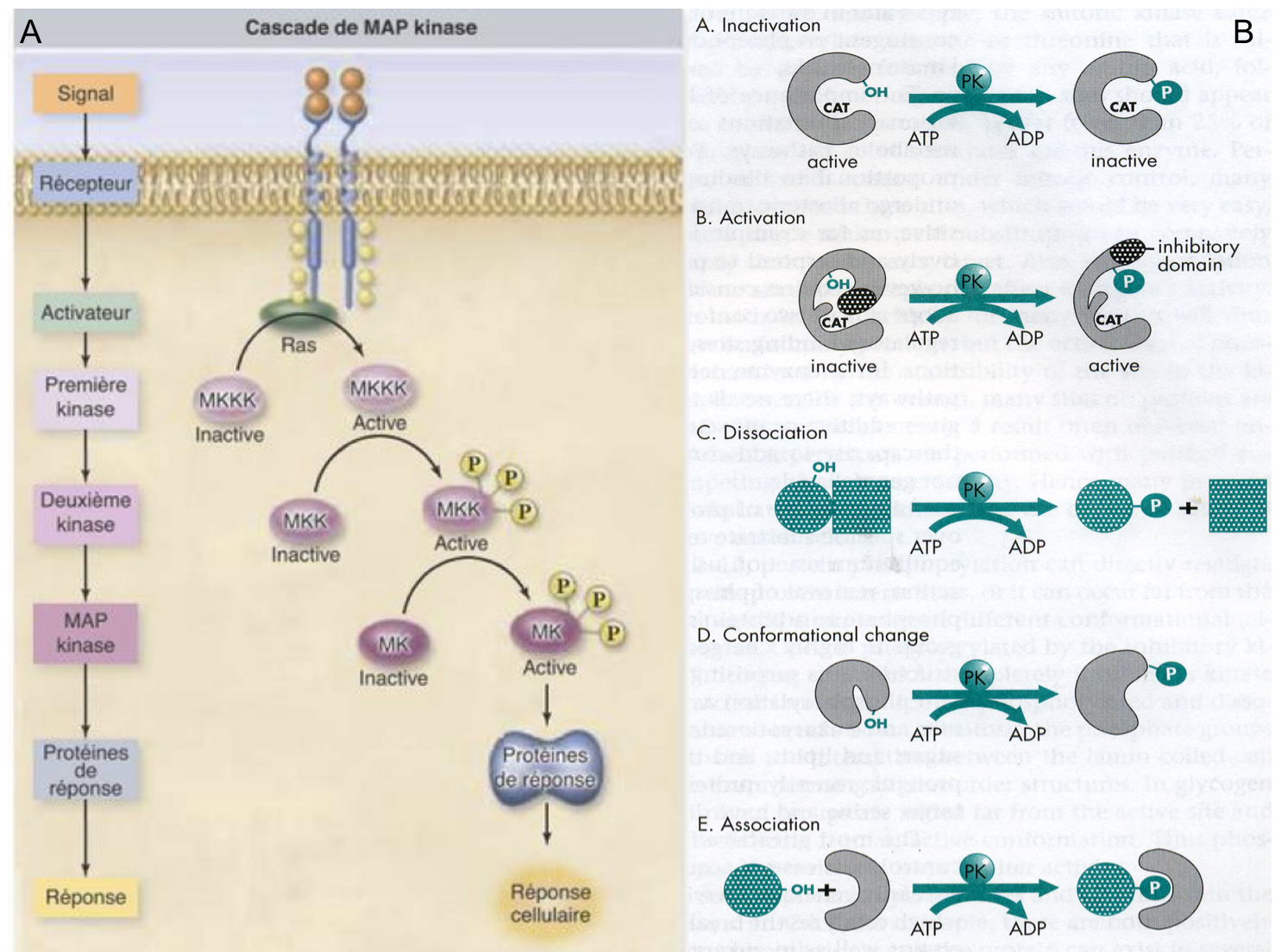
Figure 5 : (A) Transduction du signal via une cascade de phosphorylation. Seul le principe général est à
retenir (pas les noms des différents intervenants). La fixation du ligand au récepteur induit
l’activation d’une protéine nommée Ras (famille des petites protéines G ;
voir Figure 6) qui active une première kinase. S’en suit alors une cascade de
phosphorylations activant successivement différentes kinases puis un effecteur
en charge de la réponse cellulaire. NB : dans ce type de cascade, des
phosphatases interviennent également pour inactiver les kinases par
déphosphorylations (non montré). Ce type de voie de
signalisation est très conservé au sein des organismes pluricellulaires animaux
comme végétaux. (B) Représentation schématique des différents
effets que peut produire une phosphorylation sur une protéine : l’ajout
d’un groupement phosphate peut conduire à inactiver ou activer une protéine (a,
b), à la dissocier d’un partenaire (c), à modifier sa conformation et
conséquemment son activité (d) ou à permettre son interaction avec une autre
protéine (e).
Les différents types de récepteurs membranaires et le fonctionnement des voies de signalisation qui leur sont associées ne sont pas au programme mais si vous voulez y voir un peu plus clair sur la façon dont les signaux sont transduits, vous pouvez regarder la vidéo suivante :
Les réponses des cellules aux signaux extérieurs : exemple de l’activation des petites protéines G sur le remodelage du cytosquelette d’actine
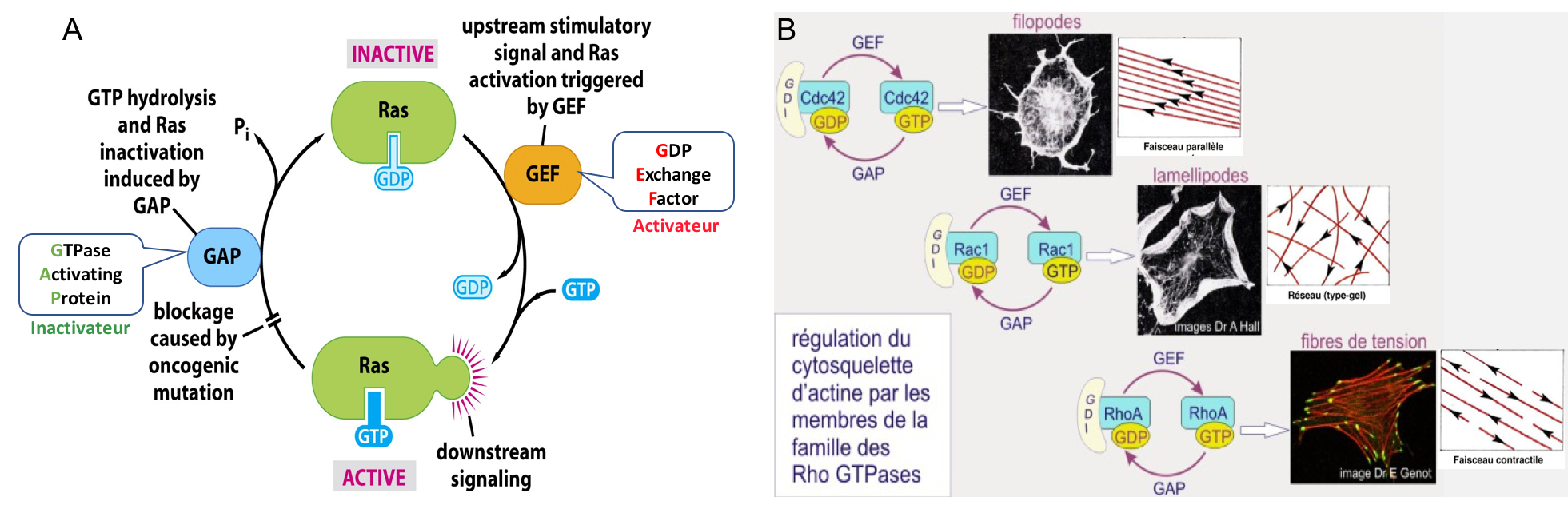
Nous avons vu que les voies de signalisation intracellulaires aboutissent à la modulation d’effecteurs intracellulaires. Parmi ces derniers figurent une classe de protéines appelées petites protéines G de type Rho (« Ras homologue », incluant les protéines Rho, Rac et Cdc42) qui jouent des rôles cruciaux dans la régulation de l’assemblage des filaments d’actine (revoir si besoin l’introduction au cytosquelette de la synthèse 1). Ce sont des enzymes à activité GTPasique (i.e. activité d’hydrolyse du GTP en GDP).
Les petites protéines G lient le GTP ou GDP : la forme liée au GTP est active ; la forme liée au GDP est inactive. Sous leur forme active (Figure 6) :
- Cdc 42 stimule la polymérisation de faisceaux parallèles d’actine, permettant la formation de filopodes.
- Rac et Cdc42 peuvent aussi stimuler la polymérisation de l’actine en réseau pour former des lamellipodes. Cela passe par l’activation de protéines de nucléation comme Arp2/3 (cf. synthèse 1).
- Rho facilite la fasciculation des filaments d’actine avec de la myosine II, formant ainsi des fibres de stress/tension. Rho stimule également la formation de contacts focaux en favorisant l’agrégation des intégrines et des protéines associées.
Les réponses des cellules aux signaux extérieurs : modulation de l’expression génique
L’exemple précédent montre comment un effecteur activé en aval d’une voie de signalisation peut moduler une activité biochimique (il s’agit en général d’une réponse rapide). La réception d’un signal peut également modifier transitoirement ou durablement l’expression du génome (stimulation ou inhibition de l’expression de certains gènes ; réponse plus lente).
Vous avez vu en Biologie moléculaire (UE GBM1/2) la machinerie de base impliquée dans la transcription des gènes (complexe d’initiation contenant l’ARN polymérase et les facteurs de transcription généraux). Si besoin revoir les bases à l’adresse suivante : https://planet-vie.ens.fr/article/1482/transcription-eucaryotes#l-initiation-de-la-transcription
La transcription de la plupart des gènes (à l’exception des gènes de ménages, exprimés de façon constitutive par toutes les cellules), est finement contrôlée, notamment au niveau transcriptionnel. Ce contrôle fait intervenir des facteurs de transcription « spécifiques » en charge de recruter le complexe d’initiation. Sous l’effet d’un signal extracellulaire, une voie de signalisation peut conduire à activer ou inhiber un facteur de transcription spécifique et donc à moduler le répertoire de gènes exprimés dans la cellule (parmi lesquels des gènes codant éventuellement de nouveaux facteurs de transcription).
La vidéo suivante (Allez ! Un peu d’anglais mais avec sous-titres !) vous montre l’exemple d’un facteur de transcription activé en aval d’une une cascade de phosphorylations intracellulaire (Figure 5) :
Les principales informations à retenir sont :
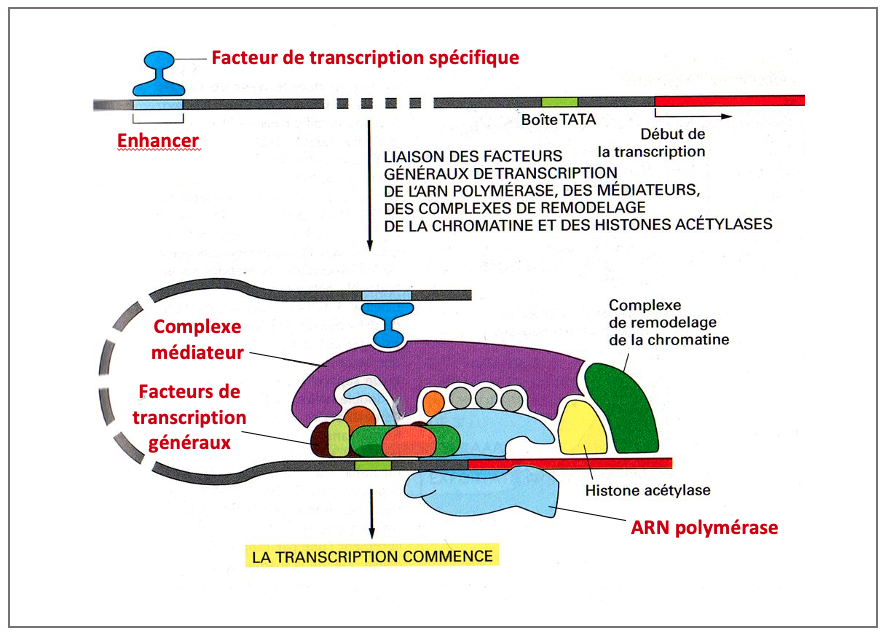
- Les facteurs de transcription reconnaissent et se lient à des séquences nucléotidiques régulatrices spécifiques (appelées « enhancers ») situées à proximité et/ou à distance (jusqu’à plusieurs dizaines de kilobases) du promoteur de leurs gènes cibles.
- Cette fixation engendre un repliement local de l’ADN qui rapproche la séquence régulatrice du promoteur. Le facteur de transcription, par l’intermédiaire d’un complexe protéique nommé « médiateur », recrute alors le complexe d’initiation au niveau du promoteur et la synthèse du transcrit peut démarrer (Figure 7).
- Les facteurs de transcription ne sont pas tous activateurs. Certains sont des répresseurs transcriptionnels.
Il existe de nombreuses familles de facteurs de transcription spécifiques et chaque type cellulaire en exprime une combinatoire spécifique qui dicte le répertoire de gènes exprimés. Pour commencer à appréhender l’importance de cette régulation transcriptionnelle dans le développement des organismes pluricellulaires, visionnez cette petite vidéo :
Une seconde manifestation/conséquence de l’interaction d’une molécule signal et de son récepteur à la membrane d’une cellule peut donc être une modification du répertoire des gènes exprimés via l’activation ou la répression de la transcription de gènes spécifiques. La liaison ligand/récepteur active une série d’intermédiaires qui in fine modulent l’expression de gènes cibles. La réponse de la cellule au signal est dictée par le « nouveau » répertoire de gènes exprimés (entrée en prolifération, modification de son identité…).
Les différents modes de communication des cellules animales
- Il existe plusieurs modes de communication chimique intercellulaire chez les animaux (Figure 8 ; on ne parlera pas ici de la communication électrique, médiée par les neurones). Si tous fonctionnent sur les principes généraux énoncés ci-dessus, ils diffèrent dans la nature du signal (signal diffusible ou signal de contact) et la distance de la source émettrice. On distingue classiquement :
- La communication endocrine (Figure 8A) : elle fait intervenir un signal appelé hormone et agissant à distance de la source sécrétrice.
- La communication paracrine (Figure 8B) : elle fait intervenir des signaux diffusibles sécrétés à proximité des cellules réceptrices. Un nombre restreint de familles de facteurs paracrines contrôlent les comportements cellulaires. Nous verrons en TD, l’exemple des protéines de la famille Wnt.
- La communication synaptique (Figure 8D) : Elle intervient dans le cadre de la communication nerveuse et s’apparente à une communication paracrine.
- La communication juxtacrine (Figure 8C), faisant intervenir un contact direct entre deux cellules ou un contact entre des cellules et leur matrice. Ce type de communication fait intervenir diverses molécules de surface dont les cadhérines (communication cellule-cellule) et les intégrines (communication cellule-matrice), qui dans ce cas, jouent le rôle de véritables « récepteurs », capables d’activer des voies de signalisation intracellulaires.
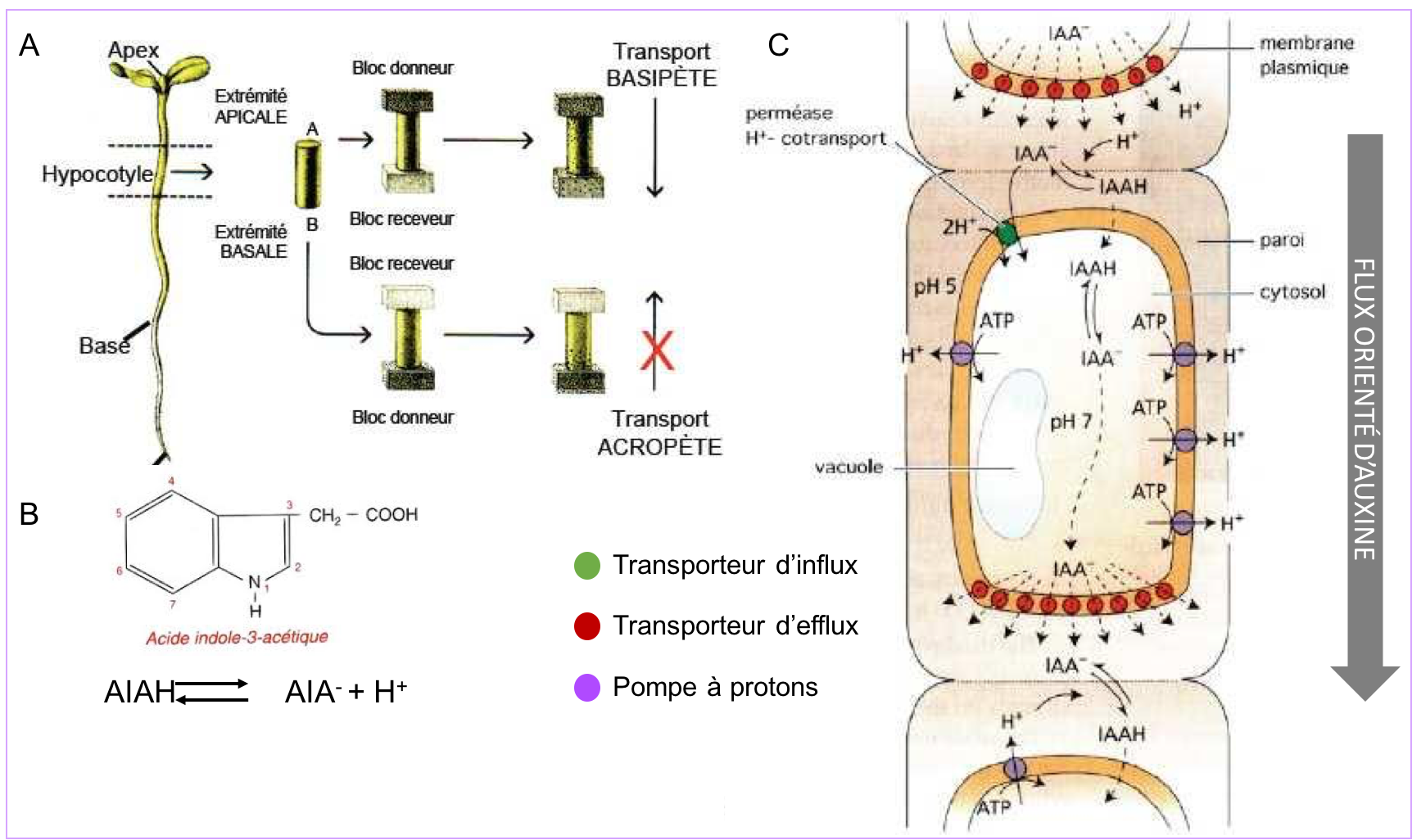
Les différents modes de communication des cellules végétales : exemple d'une phytohormone, l'auxine.
Les cellules végétales communiquent également par le biais de facteurs paracrines (exemple des facteurs de croissance et de leur voie de signalisation qui sont très conservés chez tous les organismes pluricellulaires). En outre, à l’instar de la communication endocrine des animaux, des hormones régissent le développement végétal et la physiologie de la plante. Ces phytohormones sont véhiculées par la sève (brute ou élaborée) et peuvent également circuler de cellule à cellule selon différentes modalités (par diffusion, par transport polarisé ou par la voie symplasmique ; Figure 8 A’, B’, B’’).
Parmi les phytohormones fondamentales figure l’auxine ou AIA, dont nous reverrons en synthèses 6 et 7 les fonctions dans la division, l’expansion et la différenciation des cellules végétales. La synthèse de l'auxine a lieu majoritairement dans les primordia foliaires et les jeunes feuilles puis elle est transportée à distance par la sève élaborée. La figure 9 montre les différentes modalités de son transport au sein des tissus : diffusion simple à travers les membranes ou transport polarisé. Le transport polarisé fait intervenir des transporteurs sélectifs. Ceux-ci sont de deux types, les transporteurs d’influx qui contrôlent l’entrée de l’auxine dans la cellule et les transporteurs d’efflux (de la famille PIN) qui en contrôlent la sortie.
L’expression localisée et régulée des transporteurs joue un rôle crucial dans l’ajustement du flux d’auxine et son orientation dans les tissus.
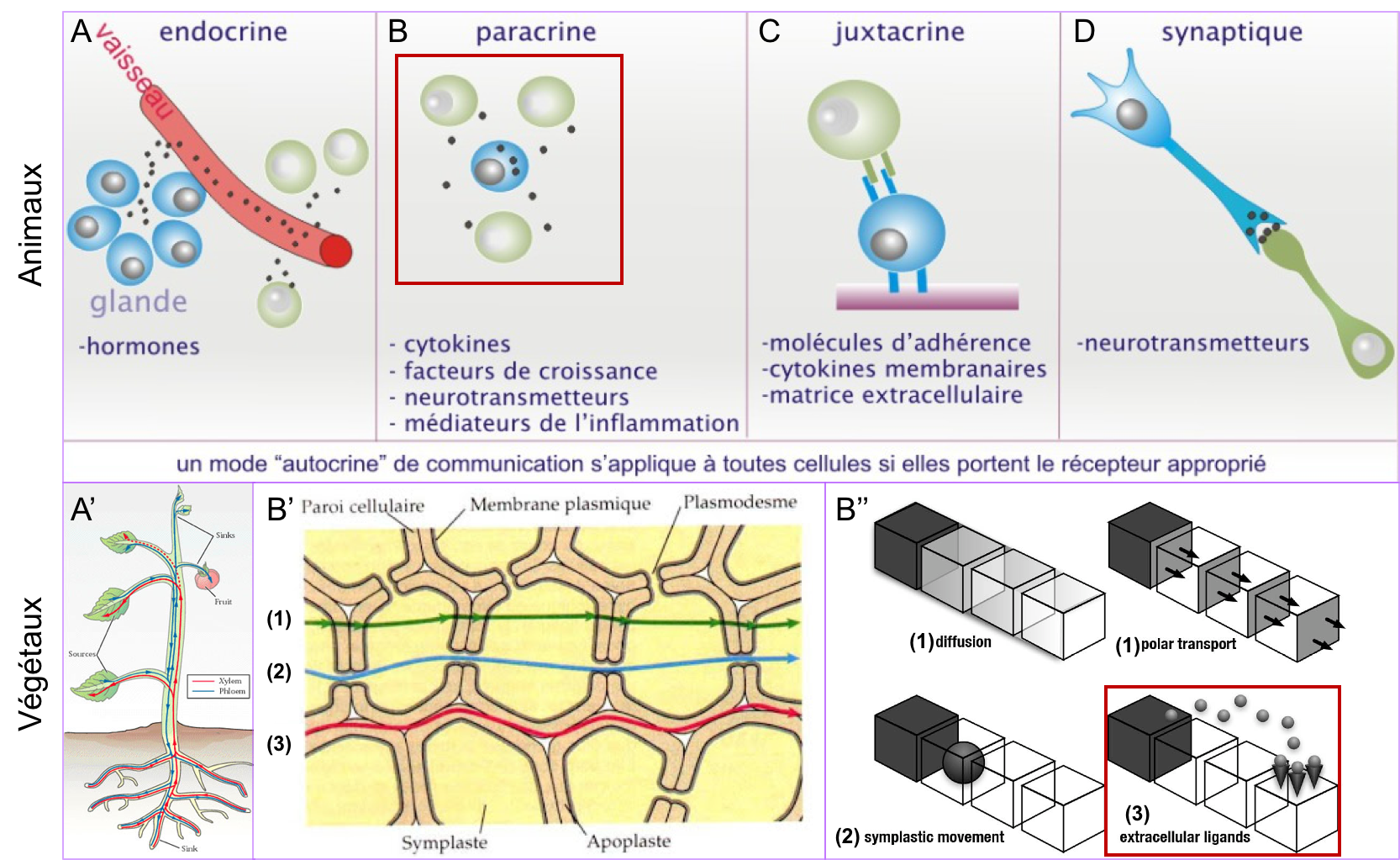
Figure 8 : Les différents modes de communication
chimique intercellulaire chez les animaux et les végétaux. (A, A’) Communication à distance par les hormones et phytohormones.
Les hormones animales sont véhiculées par la circulation sanguine (ou
l’hémolymphe chez les invertébrés), les phytohormones circulent par la sève
brute ou élaborée. (B, B’, B’’) Communication de proximité. Chez les
animaux comme chez les végétaux, des signaux paracrines peuvent être sécrétés
dans le milieu extracellulaire et diffuser vers des cellules cibles situées à
proximité (comparer les encadrés rouges en B et B’’). Dans les cellules
végétales, ces signaux paracrines circulent par la voie apoplasmique (3 en B’,
B’’). S’ajoute à cela chez les végétaux, la possibilité pour certains signaux
de circuler de cellule en cellule par diffusion ou transport polarisé au
travers des membranes et des parois (1 en B’, B’’ ; voir aussi Figure 9)
ou par diffusion de cytoplasme à cytoplasme via
les plasmodesmes (voie symplasmique ; 2 en B’ ; B’’). On notera que
les plasmodesmes ne laissent pas passer n’importe quelle molécule (limite de taille et régulation possible de leur ouverture/fermeture en fonction des conditions
physiologiques). (C) Communication
juxtacrine des cellules animales. (D) Communication
synaptique chez les animaux. Rappel synthèse 1 : L'apoplasme désigne le continuum
extracellulaire formé par les parois pectocellulosiques et les espaces vides
entre les cellules végétales. L'eau et les solutés peuvent y naviguer par
diffusion passive non sélective (3 en B’) ; Le symplasme désigne le
continuum intracellulaire formé par les cellules végétales par le biais des
plasmodesmes (2 en B’).