Synthèse 1 : STRUCTURES ET COMPOSANTS CELLULAIRES
 Ce cours en ligne synthétique reprend les points de programme suivants :
Ce cours en ligne synthétique reprend les points de programme suivants :
- Synthèse sur le cytosquelette
- Synthèse sur la matrice extracellulaire animale
- Synthèse sur la paroi végétale
Introduction au cytosquelette
Source : http://ressources.unisciel.fr/biocell/chap4/co/module_Chap4_1.html
Le cytosquelette d'une cellule est l'ensemble organisé des polymères biologiques qui lui confèrent l'essentiel de ses propriétés architecturales et mécaniques. Le cytosquelette d’une cellule définit sa forme et les divers mouvements qu’elle peut effectuer. C’est un réseau complexe de filaments et tubules protéiques qui s'étend dans tout le cytoplasme et dont l'organisation varie en fonction des différents types cellulaires. Tous les éléments du cytosquelette sont des structures protéiques allongées résultant de processus de polymérisation.
On distingue trois grandes structures protéiques :
- Filaments d'actine (microfilaments)
- Filaments intermédiaires
- Microtubules
Le cytosquelette cellulaire est une structure très
dynamique qui se réorganise continuellement. Un équilibre instable
s’établit entre polymérisation et dépolymérisation. Des variations locales
subcellulaires de concentration et d’activités d’éléments du cytosquelette
régulent différents événements cellulaires (migration, division, déformation,
croissance, mort cellulaire).
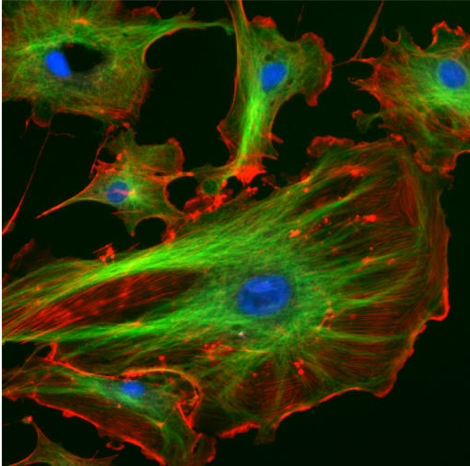
Figure 1 : Cellules endothéliales d’artère
pulmonaire bovines vues au microscope optique. En bleu, noyaux marqués au DAPI. En vert, microtubules
marqués par un anticorps. En rouge, actine marquée à la phalloïdine.
Le cytosquelette d’actine
Pour une vidéo introductive au cytosquelette d’actine, voir :
Généralités
- L’actine est la protéine la plus abondante de nombreuses cellules animales (5% au moins de la masse protéique totale des cellules non musculaires). Les filaments d'actine forment des structures dynamiques rendues plus au moins stables par des protéines associées.
- On distingue trois classes de molécules d’actine : l’actine α que l'on trouve dans les cellules musculaires (aussi bien striées que lisses) ; l’actine β et l’actine γ présentes dans les cellules non musculaires.
- Les différents types d'actine sont très semblables (90% d'identité dans leur séquence d'acides aminés).
- Un microfilament d’actine (polymère d’actine nommé actine F pour « filamenteuse ») est une hélice de 5-9 nm de diamètre formant une fibre flexible, polarisée (pôles + et -), en perpétuel remodelage (Figure 2).
- Le monomère de l’actine F (nommé
actine G pour « globulaire ») est polaire et contient un
ATP en son cœur. La polymérisation peut être stimulée ou facilitée in vivo par des
complexes protéiques. In vitro elle a lieu spontanément si la force
ionique est suffisamment élevée.
- La croissance d’un filament d’actine est plus rapide (1000 actines G/sec) au pôle (+) qu'au pôle (-).
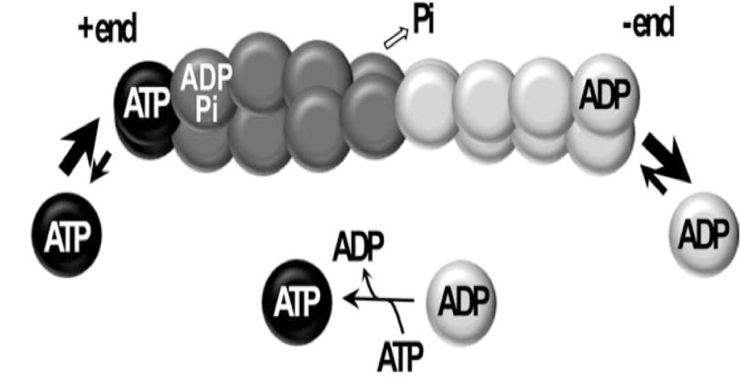
Figure 2 : Représentation schématique de l’équilibre entre allongement et raccourcissement des extrémités du filament. À l'état stable et en présence d'ATP en solution, le raccourcissement de l'extrémité (-) (dite « pointue ») est équilibré par l'allongement de l'extrémité (+) (dite « barbée ») du filament. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3670783/
Organisation en faisceaux et réseaux des filaments d’actine
Les filaments peuvent s’associer pour former des faisceaux ou des réseaux. Les faisceaux peuvent être parallèles ou anti-parallèles, contractiles ou non (Figures 3 et 4). Le cytosquelette d’actine se forme grâce à des molécules de liaison qui jouent un rôle important dans la polymérisation, la stabilisation et le couplage des filaments. Certaines de ces protéines permettent aussi d'engendrer le mouvement.
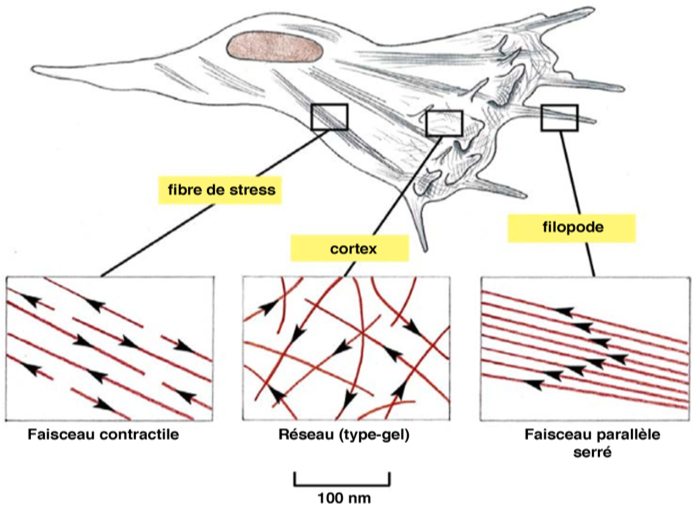
Figure 3 : Organisation des filaments d’actine.
· Les faisceaux parallèles
- Filaments orientés avec la même polarité.
- Liaison à la fimbrine (protéine intercalaire).
- Présents notamment dans les microvillosités.
· L’organisation en réseau
- Arrangement lâche, nombreuses interconnexions orthogonales.
- Liaison avec la filamine.
- Présents dans les lamellipodes et le réseau sous-membranaire (actine corticale).
· Les faisceaux contractiles
- Filaments arrangés avec des polarités opposées.
- Liaison avec des dimères d'actinine α.
- Un complexe de plusieurs molécules de myosine II est inséré entre les filaments.
- La contraction des faisceaux repose sur le glissement des fibres antiparallèles les unes contre les autres sous l’action de la myosine II qui joue le rôle de moteur moléculaire.
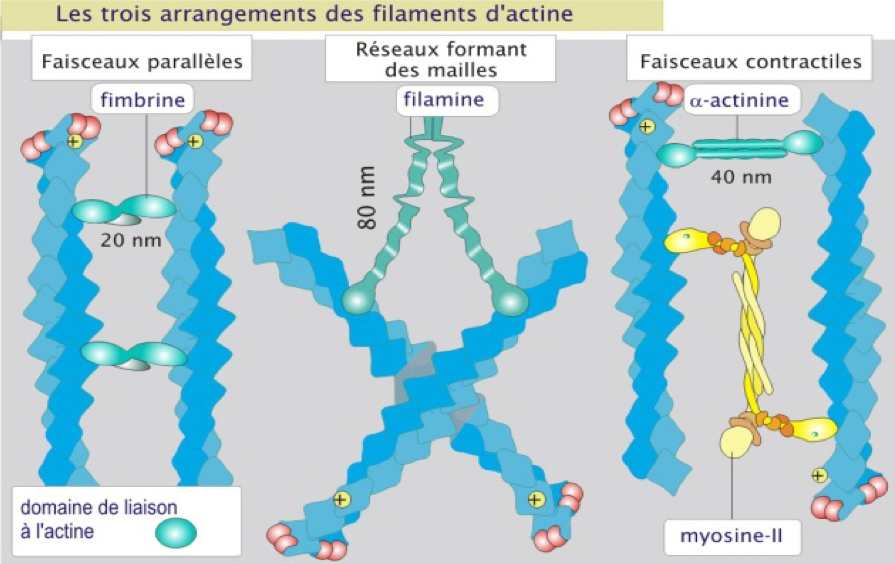
Figure 4 : Les trois types de construction de l’actine filamenteuse.
Régulation de l’assemblage et du désassemblage des filaments d’actine
Les fibres/faisceaux et réseaux d’actine sont en perpétuel remodelage. L’assemblage et le désassemblage des monomères d’actine sont régulés par diverses protéines qui modulent :
- la forme de l’actine polymérisée (linéaire ou branchée)
o Exemple : L’Actin Related Protein Arp2/3, structuralement proche de l'actine, sert de point de départ (« point de nucléation ») à la polymérisation d’une fibre branchée.
- la vitesse de l’élongation (inhibition ou accélération)
o Exemple : La profiline accélère la polymérisation.
- la stabilité des filaments
o Exemple : La cofiline favorise le désassemblage des filaments.
On peut donc distinguer deux niveaux d’organisation du cytosquelette d’actine :
- Association avec des protéines de liaison qui structurent le cytosquelette à l’échelle subcellulaire.
- Association avec des protéines qui modifient/régulent la dynamique de polymérisation/dépolymérisation de l’actine.
Les filaments intermédiaires
Les filaments intermédiaires sont des polymères protéiques, non polarisés, résistants et durables de 10 nm de diamètre, présents dans le cytoplasme de la plupart des cellules. Ils sont appelés intermédiaires car leur diamètre apparent est compris entre celui des filaments d'actine (microfilaments) et celui des microtubules. Il se polymérisent à partir de protéines fibreuses et jouent essentiellement un rôle mécanique (résistance à la déformation). Certains sont ubiquitaires comme les lamines nucléaires qui doublent la face interne du noyau cellulaire. D’autres sont spécifiques de certaines cellules, comme la kératine, typique des cellules épidermiques. Leur nature est très variable selon les cellules.
Les microtubules
Pour une vidéo introductive aux microtubules,
voir :
Généralités
Les microtubules sont des macromolécules abondantes dans les cellules eucaryotes et peuvent représenter une part importante des protéines totales (10-20% des protéines totales dans les neurones).
- Un microtubule est un polymère cylindrique creux et rigide de 25 nm de diamètre formant une fibre flexible en perpétuel remodelage.
- Un microtubule est composé de 13 protofilaments, chacun résultant de la polymérisation de dimères de tubuline (protéine globulaire).
- Chaque dimère est composé d’une molécule de tubuline α et d’une molécule de tubuline β associées de façon non covalente.
- Il existe 6 formes de tubuline α et 6 formes de tubuline β. Il existe également des tubulines γ, δ, ε que l'on ne trouve pas dans les microtubules mais dans les structures centriolaires.
Organisation des microtubules au sein des cellules
- Le microtubule est une structure polarisée dont une extrémité est capable de croissance rapide (extrémité +), tandis que l'autre extrémité se trouve le plus souvent enchâssée dans le centrosome (extrémité -).
- Le centrosome ou « centre organisateur des microtubules », est un complexe protéique organisé autour deux structures appelées centrioles. Il se trouve généralement près du noyau et son nom lui vient du fait qu'il représente approximativement le centre cellulaire.
- Les microtubules irradient dans tout le cytoplasme à partir du centrosome.
Assemblage des microtubules et instabilité dynamique
- Tubuline α et tubuline β lient le GTP ; le GTP de la forme α est non échangeable car enfoui à l'intérieur du tube tandis que le GTP de la forme β est exposé en surface et donc échangeable.
- À partir d'un centrosome, des dimères de tubuline α et β chargés en GTP sont ajoutés au pôle + (α du côté du pôle moins et β du côté du pôle plus) sont ajoutés, permettant l’élaboration des protofilaments. Les protofilaments s'assemblent latéralement entre eux pour former le microtubule, cylindre creux et rigide (Figure 5).
- Les microtubules se dépolymérisent et se repolymérisent continuellement à vitesse variable (de l'ordre de quelques secondes ou quelques minutes). On parle d’instabilité dynamique.
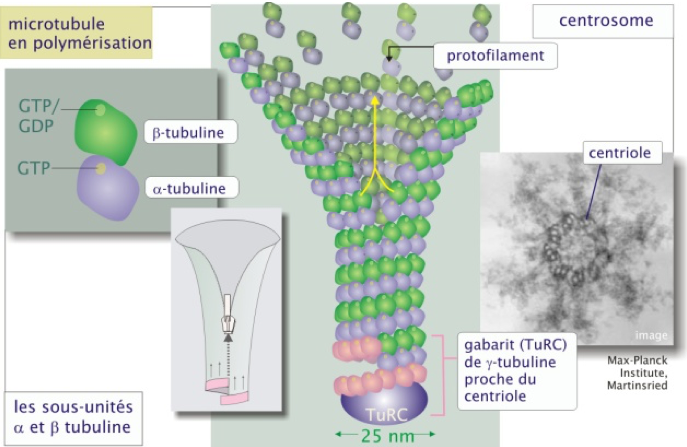
Figure 5 : Assemblage des microtubules. Le pôle (–) est enchâssé dans le centriole (bas de l’image). Le pôle (+) est l’extrémité en croissance (haut de l’image). À la périphérie du centrosome on trouve la tubuline γ faisant partie d'un complexe (Tubulin Ring Complex ou TuRC) dont la conformation sert de gabarit au microtubule en construction.
Régulation de l’assemblage et du désassemblage des microtubules
In vitro, lorsque les dimères de tubuline se détachent, ils le font en masse, phénomène qualifié de « catastrophe » (Figure 6). Dans la cellule, de nombreuses protéines régulent cette instabilité dynamique en interagissant physiquement avec les microtubules. C’est le cas notamment des « microtubule-associated proteins » MAP2 et MAP4 et de la protéine TAU (qui est aussi une MAP) qui, en s’associant au microtubule sur toute sa longueur, réduisent fortement la probabilité de déclenchement d'une dissociation brutale du microtubule (catastrophe).
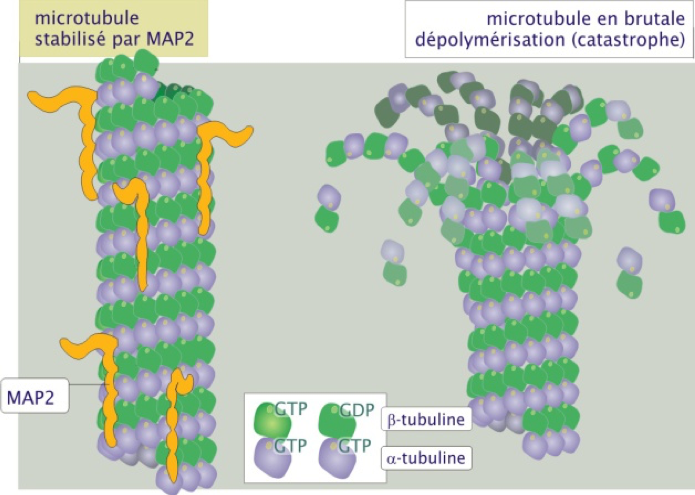
Figure 6 : Stabilisation des microtubules par les protéines de la famille MAP.
Protéines motrices interagissant avec les microtubules
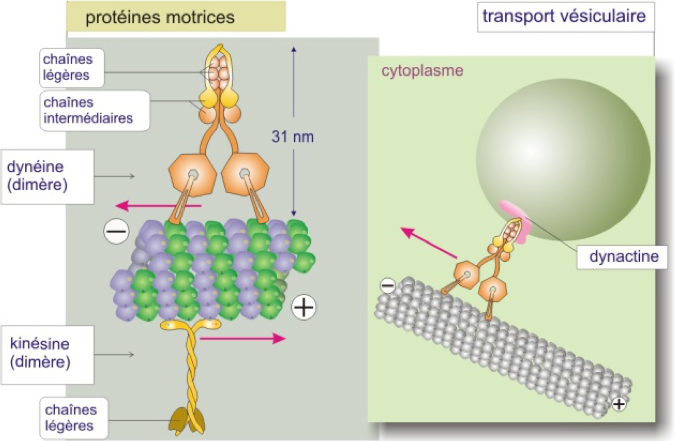
- Deux familles de protéines « motrices » (ou « moteurs moléculaires ») interagissent avec les microtubules : les kinésines et les dynéines (Figure 7). Elles se déplacent respectivement vers l'extrémité + et - (en direction du centrosome) du microtubule.
- Ces protéines motrices sont toujours associées à d'autres protéines dans un complexe qui fixe les organites cellulaires pouvant ainsi être transportés.
- À l’instar de la myosine-II, les protéines motrices utilisent l'énergie dérivée de cycles répétés d'hydrolyse de l'ATP pour se déplacer le long du microtubule.
- Le déplacement de la kinésine à la surface du microtubule se fait comme on marche sur les pierres d'un passage à gué : les deux têtes de kinésine se fixent tour à tour en effectuant à chaque fois un mouvement de semi-rotation, ce qui se traduit par une progression du dimère le long du microtubule. Le mécanisme de déplacement de la dynéine n'est pas encore élucidé.
La fonction des microtubules
Ils sont impliqués dans plusieurs processus cellulaires et notamment :
- Transport intracellulaire des organites.
- Battement des cils ou flagelles.
- Séparation des chromatides pendant la mitose.
Nous reverrons plus particulièrement leur rôle au cours de la mitose.
